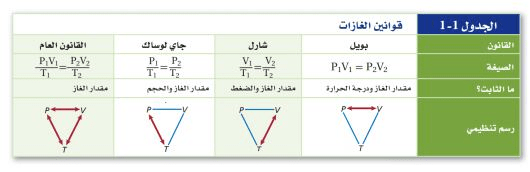
(قوانين الغازات)
الدرس الأول:
قوانين الغازات
- قانون بويل
كيف يرتبط الضغط مع الحجم؟
نص قانون بويل على أن حجم كمية محددة من الغاز يتناسب عكسياً مع الضغط الواقع عليه عند ثبوت درجة حرارته
العلاقة بين الضغط والحجم (عكسية) حيث يتجه المحنى إلى الأسفل
قانون بويل:
P1V1 = P2V2 (حيث P تمثل الضغط / وV تمثل الحجم)
حاصـل ضرب ضغط كميـة محددة من الغـاز في حجمها عند ثبوت درجة حرارتها يسـاوي كمية ثابتة
- قانون شارل
كيف يرتبط الحجم مع درجة الحرارة؟
درجة حرارة وحجم عينة من الغاز يزداد عندمـا يبقى كل من كمية العينة والضغط ثابتين
يمكن تفسـير هـذه الخاصية بناء على نظرية الحركة الجزيئية:
فعندما تزداد درجة الحرارة تتحرك جسيمات الغاز وتصطدم أسرع بجدار الإناء الذي توجد فيه وبقوة أكبر ولأن الضغط يعتمد على عدد وقوة اصطدامات جسيمات الغاز بجدار الإناء فإن هذا يؤدي إلى زيادة الضغط، وحتى يبقى الضغط ثابتا لا بد أن يزيد الحجم
إذ تحتاج الجسيمات إلى الانتقال إلى مسافات أبعد قبل أن تصطدم بالجدار، مما يقلل من عدد اصطدامات الجسيمات بجدار الإناء
رسم العلاقة بين درجة الحرارة والحجم؟
يوضح الشـكل العلاقة بين درجة الحرارة والحجـم مقدار محدد من الغاز تحت تأثير
ضغط ثابت؛ حيث إن منحني درجة الحرارة الحجم خط مسـتقيم
العلاقة بين درجة الحرارة المقايسة بالكلفن (k) والحجم عالقة طرديـة
والتناسـب مباشر؛ وعنـد مضاعفة درجة الحرارة يتضاعف الحجم
ويعرف الصفر على تدريج كلفن بالصفر المطلق، يمثل أقل قيمة لدرجة الحرارة
ينص قانون شارل أن حجم كمية محددة من الغاز يتناسب طردي درجـة حرارته بالكلفن عند ثبوت الضغط
قانون تحويل درجة الحرارة: C + 273.15 = k
العلاقة بين درجة الحرارة والحجم (طردية) حيث يتجه المنحنى إلى الأعلى
- قانون شارل:
v1/t1 = v2/t2 (حيث T تمثل درجة الحرارة بالكلفن / وV تمثل الحجم)
حاصـل قسـمة حجم كمية محـددة من الغاز عـلى درجة حرارته بالكلفن عنـد ثبوت ضغطه يساوي كمية ثابتة
- قانون جاي لوساك
كيف ترتبط درجة الحرارة مع ضغط الغاز؟
ينص قانون جاي لوساك عـلى أن ضغط مقدار محدد من الغاز يتناسـب طردياً مع درجة حرارته بالكلفن
العلاقة بين درجة الحرارة والضغط (طردية)؛ حيث يتجه المنحنى إلى الأعلى
قانون جاي لوساك:
v2/t2 = v1/t1 حيث T تمثل درجة الحرارة بالكلفن / وV تمثل الضغط
حاصـل قسـمة الضغط على درجة الحرارة بالكلفن مقدار محدد من الغاز ذي حجم ثابت يساوي مقدارا ثابتا
- القانون العام للغازات
يمكن جمع قانون بويل وقانون شـارل وقانون جاي لوسـاك في قانون واحد يسمى القانون العـام للغـازات، وهو يحدد العلاقة بين الضغط ودرجـة الحرارة والحجم لكميةّ محددة من الغاز
الضغط يتناسب عكسياً مع الحجم، وطردياً مع درجة الحرارة
القانون العام للغازات:
p1v1/t1 = p2v1/t2 (حيث T تمثل درجة الحرارة بالكلفن / وP تمثل الضغط/و V الحجم)
حاصل ضرب الضغط في الحجم مقسـوما على درجة الحرارة بالكلفن مقدار محدد من الغاز يساوي مقداراً ثابتا
(قانون الغازات المثالي)
الدرس الثاني:
مبدأ أفوجادرو
وينص مبـدأ أفوجـادرو على أن الحجوم المتسـاوية من الغـازات المختلفة تحتوي العدد نفسـه من الجسـيمات عند نفس درجة الحرارة والضغط، ويساوي 23 10*6.02
ملاذا لا ينطبق مبدأ أفوجادرو على السوائل والمواد الصلبة؟
على الرغم تفاوت حجوم الجسيمات التي تتكون منها الغازات المختلفة، إلا نظرية الحركة الجزيئية تنص على أن جزيئات الغاز تكون متباعدة بصورة تضمن ألا يكون للحجم الحقيقي للجسيم أثر في تحديد حجم الغاز
أما السوائل والمواد الصلبة فتكون الجزيئات متقاربة بعضها إلى بعض بحيث اختلافاً حجوما
الحجم وعدد المولات؟
الحجم المولاري:
الحجم الذي يشـغلهmol 1 منه عند الظروف المعيارية) /a1atm/ 0.0c
- قانون الغاز المثالي:
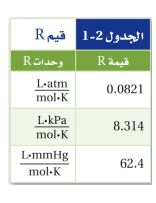
ثابت الغاز المثالي ويرمز له بالرمز R
فإذا كان الضغط مقيساً بوحدة atm فأن قيمة R هي 0.0821L.atm/mol.K
لاحظ أن وحدة R تجمع ببسـاطة وحدات المتغيرات الأربع ويبين الجدول القيم الرقمية لـ R بوحدات مختلفة للضغط
يصف قانون الغاز المثالي السلوك الفيزيائي للغاز المثالي حيث الضغط والحجم ودرجة الحرارة وعدد مولات الغاز المتوفرة
قانون الغاز المثالي:
PV = nRT
(T درجة الحرارة بالكلفن / P الضغط/ V الحجم / n عدد المولات / R ثابت الغاز المثالي)
إن حاصل ضرب الضغط في الحجم في كمية معينة من الغاز عند درجة حرارة ثابتة يساوي مقداراً ثابتا
- قانون الغاز المثالي – الكتلة المولية والكثافة
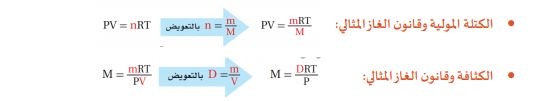
لماذا تحتـاج إلى معرفة كثافة الغاز؟
فكـر في طرائق إطفاء الحريـق تعتمد إحدى طرائق إطفـاء الحريق على منع غاز الأكسجين مـن الوصول للمادة المحترقة مـن خلال تغطية الحريق بغاز آخر لا يحترق ولا يساعد على الاحتراق، لذا يجب أن تكون كثافة هذا الغاز أكبر من كثافة الأكسجين ليحل محله.
- الغاز الحقيقي مقابل الغاز المثالي
مـاذا يعنـي مصطلح الغاز المثالي؟
- حجم جسـيمات الغاز المثالي يكاد يكون معدوماً
- ولا توجـد قـوى تجاذب بينها، ولا تتجاذب مع جدران الوعاء الموجودة فيه، ولا تتنافر معه
- وتتحرك هذه الجسـيمات حركة عشـوائية دائمة في خطوط مسـتقيمة حتى يصطدم بعضها ببعـض أو بجدار الوعاء الـذي يحتويهـا، وهذه التصادمات مرنة، مما يعني أن الطاقة الحركيـة للنظام لا تتغير
ولكـن في الحقيقـة ليـس هناك غـاز مثالي:
فجسـيمات الغاز لها حجـم وإن كان صغـيرا، وتوجد بينها قـوى تجاذب، كما التصادمات فيما بينها وبين الوعاء ليسـت تصادمـات مرنة تماما
أقصى ضغط ودرجة حرارة:
متى يكـون قانون الغاز المثالي غير مناسـب للاستخدام مع الغاز الحقيقـي؟
تحيـد معظم الغازات الحقيقية في سـلوكها عن الغاز المثالي عنـد الضغط العالي ودرجات الحـرارة المنخفضة.
القطبية وحجم الجسيمات:
تؤثر طبيعة الجسـيمات التي يتكـون منها الغاز في سـلوكه بطريقة مثالية. فمثلا يوجد بين جسيمات الغاز القطبية كما في بخار الماء قوى تجاذب أكبر من القوى الت يتكون بين جسيمات الغازات غير القطبية كالهيليوم. فتنجذب الأطراف المختلفة للجسـيمات القطبية بعضها نحو بعض بقوى تجاذب كهروسـتاتيكية، لذا لا تسلك الغازات القطبية سـلوك الغاز المثالي
وتشغل جسيمات الغازات غير القطبية الكبيرة الحجم كالبيوتان c4H10 حيزا أكبر من الحيز الذي يشـغله عدد مماثل جسـيمات غاز صغيرة الحجم كالهيليوم He ولهذا تميل جسيمات الغاز الكبيرة الابتعاد عن السلوك المثالي أكثر من جسيمات الغاز الصغيرة
(الحسابات المتعلقة بالغازات)
الدرس الثالث:
الحسابات الكيميائية: حساب الحجم
لإيجاد غاز متفاعل أو ناتج عن التفاعل الكيميائي يجب معرفة المعادلة الكيميائية الموزعة لهذا التفاعل وحجم غاز آخر مشارك في التفاعل على الأقل
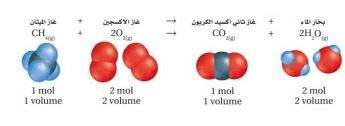
- المعاملات في المعادلة الموزعة تمثل النسب الحجمية للغازات المشاركة في التفاعل
الحسابات الكيميائية: حسابات الحجم الكتلة
المعادلة الكيميائية الموزعة تبين أعداد المولات والحجوم النسبية للغاز فقط وليس كتلها لذا يجب أن يتم تحويل كل الكتل المعطاة إلى مولات أو حجوم قبل استخدامها جزءاً من النسبة



