مذكرة الفصل الخامس الكيمياء الكهربائية مقرر كيمياء 4
الفكرة العامة
يمكن تحويل الطاقة الكيميائية إلى طاقة كهربائية كما يمكن تحويل الطاقة الكهربائية غلى طاقة كيميائية
| الخلايا الجلفانية | البطاريات | التحليل الكهربائي |
الخلايا الجلغانية
تحدث الاكسدة في الخلايا الجلفانية على الانود منيجة إلكترونات تتدفق نحو الكاثود حيث يحدث الاختزال
الخلية الجلفانية : هي نوع من الخاليا الكهروكيميائية التي تحول الطاقة الكيميائية إلى طاقة كهربائية بواسطة تفاعل الأكسدة والإختزال التلقائي .
مكونات الخلية : خلية مكونة من صفيحة خارصين في محلول كبريتات خارصين( ZnSO4 )ومن صفيحة نحاس في محلول كبريتات نحاس( CuSO4 )
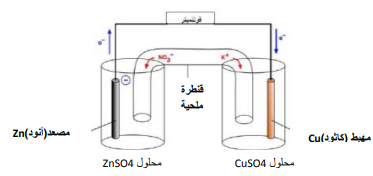
مصطلحات هامة للخلية الجلفانية :
1 -تسمى صفيحتي الخارصين والنحاس بالاقطاب .
2 -القطب الذي تحدث عنده عملية الأكسدة ( فقد الكترونات ) يسمى مصعد ( أنود ) وشحنته سالبة وهو في هذه الخلية الخارصين
3 -القطب الذي تحدث عنده عملية الإختزال ( كسب الكترونات ) يسمى مهبط ( كاثود ) وشحنته موجبه وهو في هذه الخلية النحاس
4 -إتجاه المؤشر في جهاز الفولتمتر يدل على إتجاه التيار ( حركة اإللكترونات من الأنود إلى الكاثود )
5 -القنطرة الملحية : تعمل على إكتمال الدائرة الكهربية وعن طريقها يتم إنتقال الأيونات .
الخلايا الجلفانية و الطاقة
تعد طاقة الوضع الكهربائية في الكيمياء الكهربائية مقياس كمية التيار التي يمكن توليدها من خلية جلفانية للقيام بشغل . و تستطيع الشحنة الكهربائية الانتقال بين نقطتين فقط عندما يكون هناك فرق في طاقة الوضع الكهربائية بينهما . وهاتان النقطتان في الخلايا الكهروكيميائية هما القطبان حيث تدفع الإلكترونات المتكونة عند الانود موقع التأكسد أو تتحرك نحو الكاثود بواسطة القوة الدافعة الكهربائية التي تنشأ عن وجود فرق في طاقة الوضع الكهربائية بين القطبين و تعرف بجهد الخلية . و الفولت هو الوحدة المستعملة في قياس المستعملة في قياس جهد الخلية . و فرق الجهد في الخلية الجلفانية هو إشارة إلى كمية الطاقة المتوافرة لدفع الإلكترونات من الأنود إلى الكاثود
فكلما زاد الفرق بين القطبين زاد فرق جهد الخلية و زاد فرق جهد الخلية و زاد معه أيضا جهد الخلية
السؤال : تفسير عمل الخلية الجلفانية ( خلية دانيال ) ؟
الجواب :
عند توصيل قطبي الخلية بسلك كهربائي يحدث الآتي :
عند قطب الخارصين( أنود) يتأكسد الخارصين ويتحول إلى أيونات خارصين Zn(s) Zn++ (aq) + 2e تقل كتلة فلز الخارصين مع مرور الزمن ويزداد تركيز ايونات الخارصين في المحلول. | عند قطب النحاس( كاثود) تختزل أيونات النحاس إلى فلز النحاس Cu++ (aq) + 2e- Cu(s) مع مرور الزمن تزداد كتلة فلز النحاس ويقل تركيز أيونات النحاس في المحلول |
التفاعل الكلي للخلية( مجموع نصفي تفاعل الخلية )
Zn(s) + Cu++ (aq) Zn++ (aq) + Cu(s)
حساب فرق الجهد في الخلايا الكهروكيميائية ؟
جهد الإختزال : هو مدى قابلية المادة لإكتساب الإلكترونات . ويعبر عن فرق الجهد بين القطبين بالفولت V
قطب الهيدروجين القياسي :
تم إختيار قطب الهيدروجين لقياس جهود الإختزال لكل الأقطاب الأخرى . يتكون قطب الهيدروجين من شريحه من البلاتين مغموسة في محلول HCl الذي يحتوي على أيونات الهيدروجين بتركيز 1M
وقد أتفق على أن فرق الجهد القياسي لقطب الهيدروجين ( جهد الإختزال القياسي E يساوي V 0.0 وقد تم قياس جهود الإختزال القياسية لعدد من أنصاف الخلايا وذلك بتوصيل كل نصف خلية بنصف خلية الهيدروجين القياسية ( أنظر الجدول 1-5 ص 170)
استعمال جهود الاختزال القياسية ؟
ملاحظات هامة :
1- الجهد القياسي للخلية يساعد على توقع إمكانية حدوث التفاعل تلقائيا من عدمه
2- عند تكوين خلية جلفانية من قطبين مختلفين فإن الأعلى جهدا تحدث له عملية اختزال و الأقل جهدا تحدث له عملية أكسدة
3- إذا كانت إشارة الجهد القياسي للخلية موجب دل ذلك على أن التفاعل تلقائي ( يحدث كما هو مكتوب في المعادلة )
4- إذا كانت إشارة الجهدالقياسي للخلية سالبة دل ذلك على أن التفاعل غير تلقائي ( يحدث عكس ما هو مكتوب في المعادلة )
الخلايا الجافة
البطارية : عبارة عن خلية جلفانية تنتج التيار الكهربائي . منها خلية الخارصين / كربون الجافة والخلية القلوية الجافة وخلية الفضة الجافة.
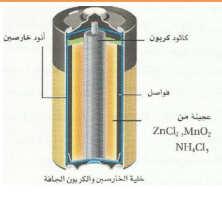 | خلية الخارصين الكربون الجافة تتكون من حافظة من الخارصين ( أنود ) تحتوي على عجينة من كلوريد الخارصين وكلوريد الأمونيم وأكسيد المنجنيز وهي تحيط بعمود من الكربون( كاثود ) . يحدث في العجينة نصف تفاعل الإختزال ودور عمود الكربون توصيل الإلكترونات فقط ( كاثود غير فعال لإنه لايساهم في تفاعل الخلية ) تفاعل الاكسدة عند الانود Zn(s)--- Zn 2+(aq) + 2e تفاعل الإختزال في العجينة ( كاثود ) 2NH4 + (aq) + 2MnO2(s) +2e- Mn2O3(s) + 2NH3(g) + H2O(l) تنتج خلية الخارصين و الكربون الجافة 1.5v |
البطاريات القلوية
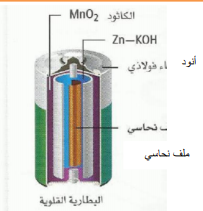 | خلية أكثر كفاءة من الخلية السابقة
يوجد الخارصين( أنود ) فيها على صورة مسحوق( يوفر مساحة أكبر للتفاعل ) ويخلط مع عجينة من هيدروكسيد البوتاسيوم توضع في علبة من الفولاذ تفاعل الاكسدة عند الانود Zn ( s) + 2OH-(aq)----- ZnO(s) + H2O(l) + 2e أما الكاثود عبارة عن مخلوط من ثاني أكسيد المنجنيز وهيدروكسيد البوتاسيوم . تفاعل الإختزال ( الكاثود ) : MnO2 (s) + 2H2O(l) + 2e- Mn(OH)2 (s) + 2OH- (aq) وهي لا تحتوي على عمود كربون . حيث تصنع بأحجام صغيرة . |
بطاريات الفضة وهي أصغر حجما من سابقتها ( أنظر الشكل 9-5 ) تستخدم في سماعات الأذن وآلات التصوير وغيرها تفاعل الكاثودAg2O(s) + H2O(l) + 2e----- 2Ag(s) + 2OH- (aq) تفاعل الأكسدة ( انود ) ZnO(s) + H2O(l) + 2e- |
والبطاريات الجافة تنقسم إلى
1 -بطاريات أولية وهى التي اليمكن إعادة شحنها مرة أخرى مثل البطاريات السابقة ( غير عكسية)
2 -البطاريات الثانوية وهي التي يمكن إعادة شحنها مرة أخرى ( يمكن عكس تفاعل الأكسدة والإختزال ويحدث ذلك اثناء شحن البطارية ( ومثال عليها بطاريات نيكل – كادميوم NiCad أنظر الشكل 10-5 ص 178. )
تفاعل الاكسدة ( عند الانود ) Cd Cd + 2e-وتفاعل الإختزال ( عند الكاثود ) NiO(OH) + 1e------ Ni(OH)2
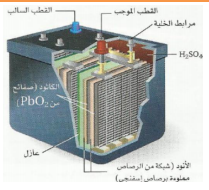 | بطاريات المركم الرصاصي ( V 12 ) هي بطارية غير جافة لأنها تحتوي على محلول موصل هو حمض الكبريت غالبا تتكون من 6 خاليا كل خلية تتكون من أنود عباره شبكة من الرصاص ومن كاثود عبارة عن شبكة من الرصاص مملوءه بأكسيد الرصاص. ومع الإستخدام يستهلك حمض الكبريت . وعند شحن البطارية ( عكس التيار ) ينتج الرصاص وأكسيده وحمض الكبريت . ( تستهلك بطاريات المركم الرصاصي عند تشغيل السيارة .وتشحن عندما يعمل المحرك) من عيوب هذا النوع أنها ثقيلة الوزن . |
بطاريات الليثيوم : وهي بطاريات تحتوي على عنصر الليثيوم بدل الرصاص وذلك لأنه خفيف وأقل جهد إختزال قياسي ( تنتج تيار أكثر ) ويمكن أن تكون أولية أو ثانوية حسب المواد المستخدمة في البطارية . ويستمر هذا النوع من البطاريات لفترة اطول من الأنواع أخرى . أنظر الشكل 12-5 ( الصفات التي تميز هذا النوع من البطاريات عن غيرها هي خفة الوزن , وطول العمر, والجهد العالي ) |
خلايا الوقود : هي خاليا جلفانية حيث يتم فيها أكسدة الوقود ( غاز الهيدروجين ) لإنتاج الطاقة الكهربائية . وهي تختلف عن البطاريات الاخرى بأنها تزود بإستمرار بالوقود . وعندما يكون الوقود المستخدم هو غاز الهيدروجين فإنه ينتج الماء مع الطاقة الكهربائية . لذلك هي تستخدم في السفن الفضائية . وتتكون خلية الوقود من قطبين من الكربون يمثال الأنود والكاثود والمحلول الموصل محلول قلوي من هيدروكسيد البوتاسيوم . حيث يتأكسد الهيدروجين عند الأنود منتج الإلكترونات ويختزل الأكسجين عند الكاثود مكون طاقة كهربائية . ويتكون الماء كناتج ثانوي من التفاعل . أنظر تفاعل الأكسدة والإختزال ص181 |




