مذكرة الفصل الثالث الأحماض والقواعد مقرر كيمياء 4
الأحماض و القواعد
خواص الأحماض و القواعد
| الاحماض | القواعد |
1 -الطعم حمضي لاذع 2 -محاليلها موصل الكهرباء 3 -تحول لون ورق تباع الشمس األزرق إلى الأحمر 4 -تتفاعل مع الفلزات ويتصاعد غاز الهيدروجين 5 -تتفاعل محاليلها المائية مع الكربونات منتجة غاز CO2 CaCO3(S) +2 HCl (aq)----- CaCl2 (aq) + H2O (l) + CO2(g) أمثلة للحوض: HCl / HNO3 / HBr / H2SO4 / CH3COOH | 1 -الطعم مر 2 -الملمس صابوني( الصابون يحضر من القواعد ) 3 -محاليلها موصلة للكهرباء 4 -تحول لون ورق تباع الشمس الأحمر إلى الأزرق أمثلة للقواعد : NaOH / NH3 / KOH / Na2CO3 |
أيونات الهيدرونيوم و الهيدروكسيد
أنظر الشكل أنظر الشكل 3-3 ص90
المحلول الحمضي يحتوي على أيونات الهيدروجين أكثر من أيونات الهيدروكسيد | المحلول المتعادل يحتوي على تركيزين متساويين من أيونات الهيدروجين وأيونات الهيدروكسي | المحلول القاعدي يحتوي على أيونات هيدروكسيد أكثر من أيونات الهيدروجين |
ينتج الماء النقي أعدادا متساوية من أيونات H ايونات OH في عمية تسمى التآين الذاتي إذ تتفاعل جزيئات الماء منتجة أيونات الهيدرونيوم H3O+ ايونات الهيدروكسيد
H2O(1) + H2O (1) ----- H3O+(aq) +OH- (aq )
أيونات أيون
الهيدروكسيد الهيدرونيوم جزيئات ماء
أيون الهيدرونيوم عبارة عن ايون هيدروجين مرتبط مع جزيء ماء بواسطة رابطة تساهمية . و يمكن استعمال الرمزين H+ و H3O بالتبادل أي وضع أحدهما مكان الآخر كما تبين المعادلة المبسطة للتأين الذاتي : H2O (1 ) ----- H+( aq) +OH(aq)
تعاريف أخرى للأحماض و القواعد
1 -نموذج أرهينيوس للأحماض والقواعد ( عالم سويدي 1883 م )
الحمض : مادة تحتوي على الهيدروجين وتتأين في المحاليل المائية منتجة أيونات الهيدروجين
HCL(g) ----H(aq) + CL(aq)
القاعدة : مادة تحتوي على مجموعة الهيدروكسيد وتتأين في المحلول المائي منتجة أيون الهيدروكسيد
NaOH(s) -----Na (aq) + OH (aq)
عيوب نموذج ارهينيوس
أنها لا تضع من ضمن القواعد مواد مثل لألمونيا NH3 وكربونات الصوديوم Na2CO3 لأنها لا تحتوي على أيون الهيدروكسيد بالرغم من أن كل منهما يذوب في الماء معطيا أيون الهيدروكسيد
NH3 (g) + H2O(l) NH4+ (aq) + OH- (aq)
2 -نموذج برونستد – لوري ( د نامركي – انجليزي)
الحمض : المادة المانحة لأيون الهيدروجين+ H القاعدة : المادة المستقبلة لأيون الهيدروجين +H
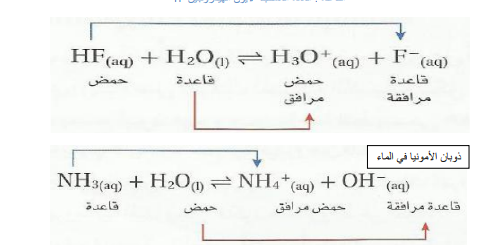
الماء - حمض و قاعدة برونستد - لورى :
تذكر أنه عندما يذوب HF في الماء فإن الماء يسلك سلوك القاعدة و عندما تذوب الامونيا NH3 في الماء يسلك سلوك الحمض . ولذا يسلك الماء سلوك الحمض أو القاعدة حسب طبيعة المواد المذابة في المحلول . و يسمى الماء و المواد الأخرى التي تستطيع أن تسلك سلوك الاحماض و القواعد مواد مترددة ( امفوتيرية )
لكل حمض قاعدة مرافقة تقل عنه بهيدروجين ….. لكل قاعدة حمض مرافق يزيد عنها بهيدروجين
مسائل تدريبية
حدد في كل معادلة مما يلي ( الحمض والقاعدة و القاعدة المراقة والحمض المرافق )
| NH4+ (aq) + OH- (aq) = NH3 (aq) + H2O1 | (HBr (aq) (l) + H2O (l) = H3O+ (aq) + Br- (aq |
| CO3-2 (aq) + H2O (l) = HCO3- (aq) + OH- (aq) | أكمل المعادلة وحدد الحمض والقاعدة والمترافقات = SO4- (aq) + H3O+ (aq) |
انظر الجدول 1-3 ص95
حمض أحادي البروتون هو الحمض الذي يمنح أيون هيدروجين واحد HF/HCl/ HNO3/ CH3COOH | حمض ثنائي البروتون هو الحمض الذي يمنح أيوني هيدروجين H2SO4/H2CO3 | حمض متعدد البروتون هو الحمض الذي يمنح أكثر من أيون هيدروجين H3PO4 |
3- نموذج لويس
الحمض : هو المادة التي لديها قابلية لتقبل زوج من الإلكترونات
القاعدة : هي المادة التي لديها قابلية لمنح زوج من الإلكترونات كيف نحدد الحمض والقاعدة حسب نظرية لويس
1 -نكتب التوزيع الإلكتروني للذرة المركزية( الوسطية)
2 -إذا كانت الذرة المركزية لديها أزواج حرة أو يحاط بها ثمانية إلكترونات يعتبر الجزيء أو األيون قاعدة .
3 -إذا كانت الذرة المركزية لا يوجد حولها ثمانية إلكترونات يعتبر الجزيءأو الأيون حمض
4 -الأيونات أحادية الذرة الموجبة تعتبر أحماض والأيونات أحادية الذرة السالبة تعتبر قواعد
مثال 1
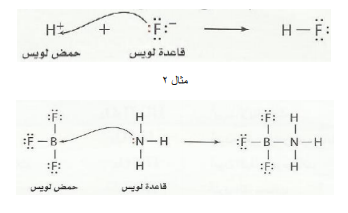
بين الحمض من القاعدة حسب لويس
| المادة | F- | AL+++ | S-- | NH3 |
| التصنيف |

السؤال : اذكر القاعدة المقترنة لكل من الحموض التالية :
| الحمض | HClO4 | HF | NH4 | HNO3 | HS - | H3PO3 |
| القاعدة المقترنة |
السؤال : اذكر الحمض المقترن لكل من القواعد التالية :
| الحمض | NH3 | S -- | NH2 - | HS - | HCO3- | Cl - | O - - |
| القاعدة المقترنة |
السؤال : صنف المواد التالية إلى قاعدة و حمض بموجب نظرية لويس ك
| المواد | PH3 | BCl3 | Cu ++ | H2O | AlCl3 | F - | S - - | H + | NH2 - |
| تصنيفها |
النشادر مادة قاعدية . بموجب النظريات الثلاث التي درست فسر ذلك موضحا إجابتك بالمعادلات الكيميائية الموزونة

قوة الأحماض و القواعد
الفكرة الرئيسة :
تتأين الأحماض و القواعد القوية في المحاليل تأينا تاما بينما تتأين الاحماض و القواعد الضعيفة في المحاليل تأينا جزئيا
التأين : هو تحويل الجزيئات غير الايونية إلى أيونات وجعلها حرة الحركة في الماء
( HCl(g) + H2O (l)------- H+ (aq) + Cl – (aq
| تعد محاليل الأحماض والقواعد من أهم المواد الموصلة للكهرباء ( الألكتروليتات( لأنها تعطي عند تأينها في الماء أيونات الهيدروجين والهيدروكسيد ( الأيونات المكونة للماء ) |
الأحماض القوية و الأحماض الضعيفة
الأحماض القوية : هي الأحماض التي تتأين كليا في الماء لتعطي أكبر عدد من الأيونات لذا هي موصلة جيدة للكهرباء
HCl (aq) + H2O(aq) H3O+(aq) + Cl-(aq)
أنظر الشكل 11-3 ص 98
الأحماض الضعيفة : هي الأحماض التي تتأين جزئيا في الماء لتعطي عدد قليل من الأيونات لذا هي ضعيفة التوصيل للكهرباء .
انظر الشكل 12-3ص99 ( انظر الشكل 3-3 ص 99 )
ثابت تأين الحمض Ka أنظر الجدول 4-3 ص 101
يسمى Ka ثابت تأين الحمض وهو قيمة ثابت الإتزان لتأين الحمض الضعيف
تدل القيم الصغيرة لثابت التأين Ka لألحماض الضعيفة على أن أكثر الحمض يوجد في صورة جزيئات غير متأينة)المقام( والقليل منها متأين )البسط
HCN (aq) + H2O (l) = H3O+ (aq) + CN- (aq)
Ka= H3O(CN)/ HCH= 6.2×10-10
القواعد القوية والقواعد الضعيفة
القواعد القوية : هي القواعد التي تتأين كليا منتجة أيونات فلزية وأيونات الهيدروكسيد مثل هيدروكسيد الصوديوم NaOH (s) Na+ (aq) + OH- (aq)
انظر الجدول 5-3 ص 102
القواعد الضعيفة : هي القواعد التي تتأين جزئيا في الماء .
مثل النشادر أنظر الجدول 6-3 ص 103 يبين ثوابت تأين القواعد الضعيفة Kb كلما صغرت قيمة Kb كانت القاعدة أضعف
ايوات الهيدروجين و الرقم الهيدروجيني
الفكرة الرئيسة : يعبر كل من pH و pOH عن تراكيز أيونات الهيدروجين و أيونات الهيدروكسيد في المحاليل المائية
ثبت عمليا أن الماء النقي موصل ضعيف جدا للتيار الكهربائي، وهذا يدل على وجود أيونات موجبة وأخرى سالبة مسؤولة عن ذلك. إن مصدر هذه الأيونات هو التأين الذاتي للماء حيث يمكن لجزيء ماء أن يمنح بروتونا لجزيء ماء آخر، فيسلك بذلك أحدهما سلوك الحمض واآلخر سلوك القاعدة
ونظرا لأن الماء يتأين بدرجة ضئيلة جدا فإن تركيزه يعد ثابتا وحيث أن ثابت الاتزان في التفاعل يعود للماء فقط فإنه يعبر عنه باستخدام الرمز Kw و يسمى ثابت تأين الماء
Kw = [H3O + ] [OH- ] Kw = 1x10-1 عند درجة c 25 |
تستخدم العلاقة السابقة لحساب تركيز أيون الهيدرونيوم، أو أيون الهيدروكسيد في الماء، أو أي محلول آخر.
حساب( +H ) و ( -OH )في الماء النقي
أن التأين الذاتي للماء يعطي تراكيز متساوية من أيونات الهيدرنيوم والهيدروكسيد
H2O + H2O = H3O + OH عند االإتزان Kw = [H3O + ] [OH- ] = 1X 10-14 OH- ) = ( H3O+) ) لإن ( Kw = ( H3O + ) ( H3O 1×10-14√ = (H3O) MOL/L1×10-7 = ( H3O ) (OH) = 1×10-7 MOL/L |




