عرض بوربوينت القانون العام للغازات كيمياء 2-3 مسارات أ. ماجد الحكمي
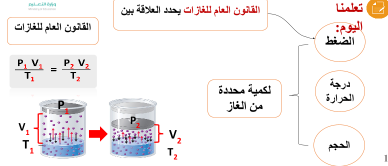
القانون العام للغازات
قانون جاي - لوساك
تقويم:
تحفيز إذا كان ضغط عينة من الغاز يساوي 30.7 kPa عند درجة حرارة 00.0°C، فكم ينبغي أن ترتفع درجة الحرارة السيليزية للعينة حتى يتضاعف ضغطها؟

القانون العام للغازات
سنتعلم اليوم:
1) تَحّدِيد المتغيرات في القانون العام للغازات .
2) كتابة نص القانون العام للغازات .
3) توضيح نوع العلاقة بين الحجم ودرجة الحرارة و الضغط .
4) حل بعض التمارين على القانون العام للغازات .
القانون العام للغازات
التهيئة
هل يمكن تغيير الضغط والحجم و درجة الحرارة معاً ؟
الجواب :
القانون العام للغازات
الربط بالمعرفة السابقة
السؤال : ما العلاقة بين القوانين الثلاثة والقانون العام للغازات ؟
الجواب :

القانون العام للغازات
نص القانون العام للغازات
هو يحدد العلاقة بين الضغط ودرجة الحرارة والحجم لكمية محددة من الغاز .
القانون العام للغازات
العلاقة الرياضية للقانون العام للغازات
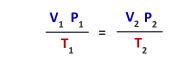
▪حاصل ضرب ضغط في الحجم مقسوماً على درجة الحرارة المطلقة. لمقدار محدد من الغاز يساوى مقداراً ثابتاً.
▪يجب التعبير عن درجة الحرارة بالكلفن (K)
P1 : تمثل الضغط الابتدائي
P2 : تمثل الضغط النهائي
T2 : تمثل درجة الحرارة النهائية
T1 : تمثل درجة الحرارة الابتدائية
V1 : تمثل الحجم الابتدائي
V2 : تمثل الحجم النهائي
القانون العام للغازات
السؤال : العلاقة بين المتغيرات الثلاث درجة الحرارة والضغط والحجم ؟
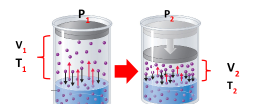
القانون العام للغازات
السؤال : لماذا يعد القانون العام للغازات هاماً ؟
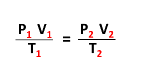
الجواب :
1- يساعد على حل المسائل التي تتضمن أكثر من متغير واحد .
2- يقدم لك طريقة لتذكر القوانين الثلاثة الأخرى دون تذكر معادلاتها .
القانون العام للغازات
تدريب1
إذا كان حجم كمية من غاز ما تحت ضغط 110 Kpa ودرجة حرارة 30⁰C يساوي 2L وارتفعت درجة الحرارة إلى 80⁰C وزاد الضغط وأصبح 440 Kpa فما مقدار الحجم الجديد ؟
المعطيات P1 = 110.0 Kpa T1 = 30.0 ⁰C V1 = 2.00 L T2= 80.0 ⁰C P2= 440 Kpa | المطلوب V2 = ? Tk = 273 + TC T1 = 273 + 30.0 ⁰C T1=303.0 K T2= 273 + 80.0 ⁰C T2=353.0 K
|

القانون العام للغازات
تدريب 2
افترض أن كمية الغاز ثابت في المسألة التالية :
تحدث عينة من الهواء في حقنة ضغط مقدارها 1.02 atm عند 22⁰C ووضعت هذه الحقنة في حمام ماء يغلي درجة حرارته 100⁰C وازداد الضغط إلى 1.23 atm بدفع مكبس الحقنة إلى الداخل مما أدى إلى نقصان الحجم إلى 0.224m فكم كان الحجم الابتدائي ؟
المعطيات
P1 = 1.02 atm
T1 = 22.0 ⁰C
T2= 100.0 ⁰C
V2 = 0.224 ml
P2= 1.23 atm

القانون العام للغازات
تدريب3
افترض أن كمية الغاز ثابت في المسألة التالية :
أسطوانة تحتوي في أعلاها مكبس تحتوي على 30ml من غاز عند 1atm و 0.00⁰C إذا زادت درجة الحرارة في الاسطوانة لتصل إلى 30⁰C وزاد الضغط إلى 1.2atm فهل يتحرك مكبس الاسطوانة إلى أعلى أم أسفل ؟
المعطيات
P1 = 1.0 atm
T1 = 00.0 C
T2= 30.0 C
V1 = 30.0 ml
P2= 1.2 atm
المطلوب
V2 = ?

القانون العام للغازات
مقاييس درجة الحرارة وقوانين الغازات
تؤثر متغيرات الضغط والحرارة والحجم في عينة من الغاز

القانون العام للغازات
تدريب 4
السؤال : يربط القانون العام للغازات المتغيرات التالية:
أ- الضغط والكثافة عند ثبوت درجة الحرارة.
ب- درجة الحرارة والحجم عند ثبوت الضغط.
ج- الضغط والحجم ودرجة الحرارة السيليزية.
د- يربط القانون العام للغازات المتغيرات التالية:
ع- الضغط والحجم ودرجة الحرارة المطلقة.
تدريب5
السؤال : العلاقة الرياضية للقانون العام للغازات هي:

القانون العام للغازات
تقويم:
السؤال : استنتج لماذا تضغط الغازات التي تستخدم في المستشفيات ومنها الأكسجين ؟ ولماذا يجب حمايتها من ارتفاع درجات الحرارة ؟ وماذا يجب أن يحدث للأكسجين المضغوط قبل استنشاقه؟
الجواب :
القانون العام للغازات
القانون العام للغازات يحدد العلاقة بين