عرض بوربوينت الخصائص الكيميائية علوم سادس ابتدائي ف3
بداية
استراتيجية الاسئلة الحافزة
السؤال : هل يمكن للأحماض أن تسبب تآكل المواد كما في الصورة ؟
الجواب : نعم، يمكن أن تسبب الحموض تآكل بعض أنواع الصخور مثل الرخام.
السؤال : ما بعض الحموض التي تعرفيها ؟
الجواب : الخل، الحمضيات ( ليمون ، برتقال ) عصارة الهضم في المعدة التي تسبب حرقان في المريء عن صعودها من المعدة
أهداف هذا الدرس
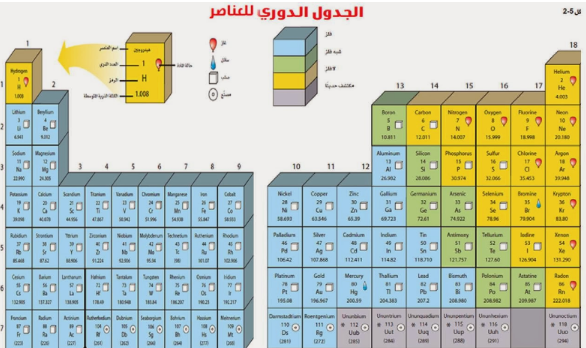
1- تصفي توزيع العناصر في الجدول الدوري.
2- توضحي كيف يكشف عن الأحماض والقواعد.
مفردات الدرس
الملح - الكاشف - الحمض - الخاصية الكيميائية - التعادل - القاعدة

ورق تباع الشمس من الكواشف يصبح أحمر في الحمض وأزرق في القاعدة
سنشاهد معاً في الشريحة القادمة فيديو عن موضوع درسنا

استراتيجية الملاحظة و الكتابة
وبعد مشاهدة الفيديو أيتها المبدعة 3 دقائق
اكتبي سطرين أو ثلاثة أسطر في ورقة تعبري فيها عن أهم الملاحظات والمعلومات التي شاهدتيها بالفيديو
انتهى الوقت : والآن من تريد أيتها المبدعات أن تُسمعنا وتقرأ علينا ملاحظاتها التي سجلتها في ورقتها
ما الخصائص المختلفة للعناصر؟
تصف الخاصية الكيميائية طريقة تفاعل المادة مع مواد أخرى.
تم ترتيب العناصر الكيمائية في الجدول الدوري حسب تزايد العدد الذري.
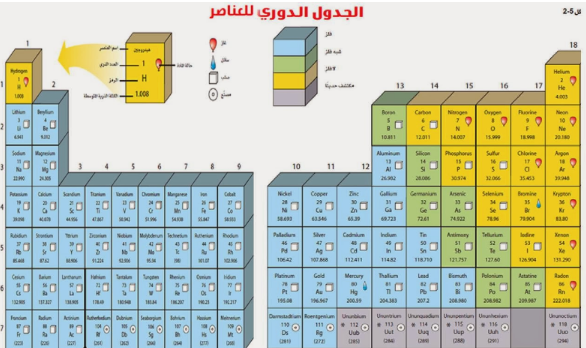
الفلزات
الفلزات تقع في يسار الجدول الدوري وتم تمييزها باللون الأزرق.
والفلزات مثل : الذهب والحديد والنحاس والفضة والنيكل وغيرها.
ومن خصائص هذه الفلزات هو أنها ( لامعة وقابلة للثني وتوصل الحرارة والكهرباء ).
أنواع الفلزات
1- الفلزات القلوية
تقع الفلزات القلوية في العمود الأول من اليسار ماعدا الهيدروجين.
مثل : الصوديوم والبوتاسيوم . تتميز هذه الفلزات بالليونة .
ولا توجد بشكل منفرد بالطبيعة بل مرتبطة مع عناصر أخرى نظراً لنشاطها الكيميائي.

2- الفلزات القلوية الارضية
وبعدها تأتي الفلزات القلوية الأرضية.
هذه الفلزات خفيفة .
مثل : الكالسيوم والماغنسيوم.
هذان العنصران أساسيان للعديد من المخلوقات الحية
3- الفلزات الانتقالية
تقع الفلزات الانتقالية في وسط الجدول الدوري.
عددها كبير.
مثل : النحاس والحديد والذهب والنيكل .
معظمها قاسية ولامعة وتتفاعل ببط مع العناصر الأخرى.
تستعمل الفلزات الانتقالية في صناعة النقود المعدنية والمجوهرات والآلات وغيرها الكثير.

اشباه الفلزات و اللافلزات
توجد أشباه الفلزات واللافلزات بالجهة اليمنى للجدول الدوري.
أشباه الفلزات باللون الأخضر.
واللافلزات باللون الأصفر.
أشباه الفلزات : تأخذ خصائص من الفلزات ومن اللافلزات.
مثال : السليكون عند درجات الحرارة العالية يوصل الحرارة (مثل الفلزات) وعند درجات الحرارة المنخفضة لا يوصل (مثل اللافلزات).

اشباه الفلزات و اللافلزات
اللافلزات : خصائصها عكس الفلزات تماماً.
مثل : الأكسجين والكربون والنيتروجين .
أغلبها ( غازات ).
العمود الأخير في اللافلزات يسمى الغازات النبيلة . مثل : الهيليوم.

استراتيجية ( التفكير الناقد) (نشاط شفوي )
السؤال : ما أهم خصائص اللافلزات إذا علمتي أنها عكس خصائص الفلزات ؟
الجواب : لا توصل الحرارة والكهرباء
ما الأحماض وما القواعد ؟
استراتيجية اكتشف الخطأ
عزيزاتي : توزعن الآن لمجموعات ثلاثية ولتأخذ كل طالبة موضوع من هذه المواضيع الثلاث
1- الأحماض -2- القواعد -3- الكواشف
الآن لتقرأ كل طالبة موضوعها لوحدها وتلخص بورقة أهم المفاهيم والأفكار الوارده
في موضوعها
الآن لتقوم كل طالبة بدور (المعلمة) وتشرح لزميلتيها ما تعلمته عن موضوعها وأثناء الشرح ( تتعمد وضع معلومة خاطئة واحدة )وتتناقش الطالبتان بعد انتهاء الشرح لاكتشاف الخطأ الوارد بالشرح .
وتقوم كل طالبة بالمجموعة بنفس الخطوات السابقة
مقياس الرقم الهيدروجيني PH
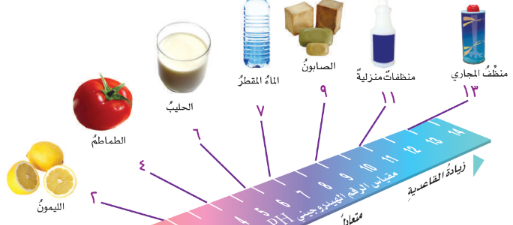
الأحماض : مواد حارقة عن لمسها.
المواد الحارقة (هي المركزّة) مثل حمض الهيدوركلوريك.
تتفاعل مع الفلزات مكوّنة غاز هيدروجين.
مثل : الحليب والطماطم والليمون.
مقياس الرقم الهيدروجيني PH

القواعد : مواد ذات طعم مر . ملمسها صابوني.
تتفاعل مع الفلزات مكوّنة غاز هيدروجين.
مثل : المنظفات والصابون.
مقياس الرقم الهيدروجيني PH

الكواشف : مواد يتغير لونها عند وجود الحمض أو القاعدة.
مثل : تباع الشمس .
هناك مواد مجهولة وخطيرة وسامة ولكي نتعرف عليها نستعمل هذه الكواشف ولا نستخدم حاسة التذوق أبداً.
استعالات الاحماض و القواعد
لها استعمالات مهمة وعديدة في حياتنا.
فتستخدم في صناعة البلاستيك والنسيج.
أكثر الأحماض استعمالاً : حمض الكبريتيك وحمض النيتريك وحمض الهيدروكلوريك.
أكثر القواعد استعمالاً : هيدروكسيد الصوديوم في صناعة المنظفات .
وتستخدم القواعد في صناعة المنظفات لأنها زلقة وتزيل الدهون والزيوت .

ما خصائص بعض الاملاح ؟
اقرأي النص التالي بتمعن وسجلي البيانات بالجدول الذي بين يديك اثناء القراءة
ما خصائص بعض الاملاح ؟
يعد حمض الهيدروكلوريك من المواد الخظرة و هيدروكسيد الصوديوم مادة قاعدية خيرة أيضا ، ولكن عند خلطهما معا ينتج ملح الطعام ( كلوريد الصوديوم ) و الملح مركب ناتج عن تفاعل حمض و قاعدة
ويسمى التفاعل الذي يتم عند خلط حمض مع قاعدة التعادل و ينتج عنه ملح و ماء
تمتاز معظم الاملاح بارتفاع درجة انصهارها و صلابتها وبعضها قابل للذوبان بسهولة ومحاليل الاملاح موصلة للتيار الكهربائي
هناك انواع عديدة من الاملاح فكبريتات الماغنسيوم MgSo4 ( ملح ابوم ) تستعمل في الاستحمام لانها تهدئ العضلات كما تستعكل كبريتات الباريوم BaSO4 للمساعدة على تصوير بعض اعضاء الجسم باستخدام الاشعة السينية و يستعمل بروميد الفضة AgBr في إنتاج التصوير الفوتوغرافية ويستعمل الملح للمساعدة على صهر الجليد على الطرق و حفظ الاطعمة
مراجعة الدرس
افكر و اتحدث و أكتب
1- المفردات . تسمى المادة التي يتغير لونها عند وجود الحمض أو القاعدة الكاشف
السؤال : استنتج لماذا تعد القواعد منظفات جيدة ؟
| إرشادات النص | الاستنتاجات |
| القواعد تتفاعل مع الدهون و الزيزت و تفككها | القواعد مواد جيدة للتنظيف |
السؤال : التفكير الناقد . اوضح لماذا لا توجد الفلزات القولية منفردة في الطبيعة ؟
الجواب : القلويات تتفاعل بشدة ، ولذلك من السهل تفاعلها مع ناصر اخرى و تكوين مركبات جديدة
السؤال :اختار الإجاية الصحيحة
أي الخيارات الآتية صحيح عندما يوضع الحمض و القاعدة معا ؟
أ- لا يتفاعلان
ب- ينتجان ملحا وماء ( صح )
ج- يصبح الحمض اقوى
د- تصبح القاعدة اقوى
السؤال : اختار الإجابة الصحيحة
اين تقع المواد المتعادلة ومنها الماء المقطر على مقياس الرقم الهيدروجيني ؟ عند الرقم
أ- صفر
ب- 2
ج- 7 ( صح )
د- 14
السؤال : اكمل كلا من الجمل الآتية بالمفردة المناسبة :
القاعدة - التفير الكيميائي - الخصائص الكيميائية - تفاعلات طاردة للطاقة - تفاعل الاتحاد - المواد المتفاعلة- الكواشف - البناء الضوئي
1- تكون الصدأ على مسمار حديد مثال على التغير الكيميائي
2- تعتمد الطريقة التي تتفاعل بها المادة مع مادة أخرى على الخصائص الكيميائية للمادة
3- تسمى المواد التي توجد قبل حدوث التغير الكيميائي المواد المتفاعلة
4- المادة التي تحول لون ورقة تباع الشمس من اللون الاحمر إلى اللون الاورق هي القاعدة
5- تسمى المواد التي يتغير لونها عند وجود الحمض أو القاعدة الكواشف
6- يحدث تفاعل الاتحاد عندما ترتبط عناصر أو مركبات لتكوين مركبات اكثر تعقيدا
7- تسمى التفاعلات التي تطلق طاقة تفاعلات طاردة للطاقة
8- البناء الضوئي . مثال على تفاعل كيميائي ماص للطاقة



