حل الفصل الثاني الطاقة والتغيرات الكيميائية كتاب كيمياء 3 للمرحلة الثانوية و حلول كتاب الكيمياء 3 المرحلة الثانوية للعام الدراسي 1442 هـ.
يتضمن الفصل الثاني أربعة دروس هي على الترتيب: الطاقة - الحرارة - المعادلات الكيميائية الحرارية - حساب التغير في المحتوى الحراري، بالإضافة إلى تقويم الفصل.
الفصل الثاني الطاقة والتغيرات الكيميائية
نكمل معكم باستعراض حلول الفصل الثاني في حل كتاب كيمياء 3 مقررات ثانوي وهو ثاني فصول الكتاب لهذا الفصل الدراسي.
حل درس الطاقة

مسائل تدريبية
السؤال : تحتوي حبة حلوى الفواكه و الشوفان على 142Cal من الطاقة . ما مقدار الطاقة بواحدة cal ؟
الجواب :
142 𝐶𝑎𝑙 : 142 = 𝐾𝑐𝑎𝑙
نحول من وحدة 𝐾𝑐𝑎𝑙 إلى وحدة 𝐶𝑎𝑙
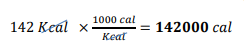
السؤال : يطلق تفاعل طارد للطاقة 86.5Kjمن الحرارة . ما مقدرا الحرارة التي أطلقت بوحدة 𝐾𝑐𝑎𝑙 ؟
الجواب :

السؤال :تحفيز عرف وحدة طاقة جديدة ، وسمها باسمك ، واجعل قيمتها عشر سعر . ما عوامل التحويل التي تربط هذه الوحدة الجديدة مع الجول J، ومع ال سعر الغذائي Cal ؟
الجواب :
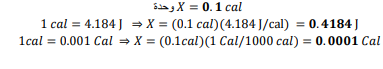
السؤال : إذا ارتفعت درجة حرارة g 4.34 من الإيثانول من C 25 إلى C8.78 ، فما كمية الحرارة التي امتصها الإيثانول ؟ ارجع إلى الجدول 2ـ2
الجواب :
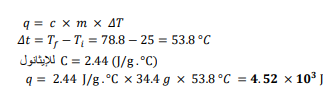
السؤال : سخنت عينة من مادة مجهولة كتلتها g 155 من C 25 إلى C 0.40 فامتصت J 5696 من الطاقة . ما الحرارة النوعية للمادة ؟ عيّن المادة بالرجوع إلى الجدول 2-2.
الجواب :
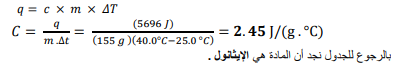
السؤال : تحفيز قطعة من الذهب النقي كتلتها 4.50g ، امتصت j 276 من الحرارة ، وكانت درجة حرارتها الأولية C 25. ما درجة حرارتها النهائية ؟
الجواب :
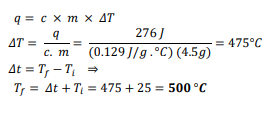
التقويم
السؤال : وضح كيف تتغير الطاقة من شكل إلى آخر في التفاعل الطارد للطاقة والتفاعل الماص لها .
الجواب : في التفاعل الطارد للحرارة تتحول طاقة الوضع المخزونة بين روابط الجزيئات المتفاعلة إلى طاقة حرارية أما في التفاعل الماص للحرارة فتتحول الطاقة الحرارية التي تمتصها الجزيئات إلى طاقة وضع كيميائية تختزن في الروابط بين الجزيئات
السؤال : ميز بين الطاقة الحركية وطاقة الوضع في الأمثلة التالية : مغناطيسين منفصلين ، انهيار ثلجي ، كتب موضوعة على رفوف ، نهر ، سباق سيارات ، فصل الشحنات في بطارية .
الجواب :
مغناطيسين منفصلين: عند وجود المغناطيسين على مسافة تكون طاقة الوضع كبيرة وعندما يتجاذب المغناطيسان تتحول طاقة الوضع إلى طاقة حركة وتقل طاقة الوضع.
انهيار ثلجي: عند بداية االنهيار يوجد طاقة وضع وعند حدوث اللأنهيار تتحول طاقة الوضع إلى طاقة حركة.
كتب موضوعة على رف : طاقة وضع .
نهر: عند بداية المصب تكون طاقة الوضع ثم تتحول إلى طاقة حركة أثناء سير النهر.
سباق سيارات: عن بداية السباق تكون طاقة الوضع أعلى ما يمكن ثم تتحول إلى طاقة حركة حتى تسكن عند خط النهاية.
فصل الشحنات في بطارية: في البداية تكون طاقة الوضع أعلى ما يمكن ثم عند تحريك الشحنات تتحول طاقة الوضع إلى طاقة حركة
السؤال : وضح علاقة الضوء والحرارة في شمعة محترقة بطاقة الوضع الكيميائية .
الجواب : تتحول طاقة الوضع الكيميائيّة الموجودة في الشمعة إلى طاقة في صورة ضوء وحرارة ،وتنطلق هذه الطاقة عندما يحدث تفاعل احتراق كيميائي
السؤال : احسب كمية الحرارة الممتصة عند تسخين 50.0g ألومنيوم من درجة حرارة25 C إلى درجة C° 0.95 علما أن الحرارة النوعية للألومنيوم 0.897J/gC
الجواب :
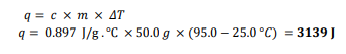
السؤال : تفسير البيانات وضعت كتل متساوية من الألومنيوم والذهب والحديد والفضة تحت أشعة الشمس في الوقت نفسه ولفترة زمنية محددة . استعمل الجدول 2 ـ2 لترتيب الفلزات الأربعة وفق ازدياد درجات حرارتها من الأعلى إلى الأقل .
الجواب : يتناسب تغير درجة الحرارة تناسبا عكسيا مع الحرارة النوعية و يكون ترتيب الفلزات على النحو الآتي :
ذهب ثم فضة ثم حديد ثم ألومينوم
حل درس الحرارة

مسائل تدريبية
السؤال : عينة من فلز كتلتها g 0.90 امتصت J 6.25 من الحرارة عندما ازدادت درجة حرارتها 1.18 c ما الحرارة النوعية للفلز ؟
الجواب :
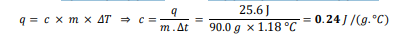
السؤال : ارتفعت درجة حرارة عينة من الماء من C°0.20 إلى C 6.46 عند امتصاصها j 5650 من الحرارة . ما كتلة العينة ؟
الجواب :
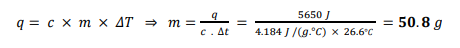
السؤال : ما كمية الحرارة التي تكتسبها صخرة من الجرانيت كتلتها 10 × 00.2 إذا ارتفعت درجة حرارتها من 0.10Cإلى 0.29C إذا علمت أن الحرارة النوعية للجرانيت (C.°g /(J 803.0 ؟
الجواب :
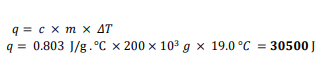
السؤال : تحفيز إذا فقدت g 335 من الماء عند درجة حرارة g 5.65 كمية حرارة مقدارها j 9750 ، فما الحرارة النهائية للماء ؟
الجواب :
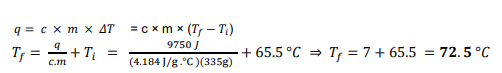
التقويم
السؤال : صف كيف تحسب الحرارة المكتسبة أو المنطلقة من المادة عندما تتغير درجة حرارتها ؟
الجواب : الحرارة المكتسبة أو المنطلقة تساوي الحرارة النوعية مضروبة في كتلة المادة ومضروبة في التغير في درجة حرارتها .
السؤال : شرح لماذا تكون إشارة H ∆سالبة للتفاعل الطارد للحرارة ؟
الجواب : 𝐻 - 𝑟𝑥𝑛 = 𝐻𝑝𝑟𝑜𝑑𝑢𝑐𝑡𝑠 − 𝐻𝑟𝑒𝑎𝑐𝑡𝑎𝑛𝑡∆
في حالة التفاعل الطارد للحرارة تفقد الحرارة وتكون 𝐻𝑝𝑟𝑜𝑑𝑢𝑐𝑡𝑠 < 𝐻𝑟𝑒𝑎𝑐𝑡𝑎𝑛𝑡 لذا تكون الإشارة سالبة
السؤال : اشرح لماذا يشكل الحجم المعلوم من الماء جزءاً مهماً من المسعر ؟
الجواب : حجم الماء يساوي كتلته نظراً لأن كثافة الماء 1g/ml
والماء يمتص الطاقة التي يفقدها الجسم الموضوع بداخله وفقا للعلاقة q=c × m × ∆t
السؤال : اشرح لماذا يجب أن تعرف الحرارة النوعية للمادة حتى تحسب الحرارة المكتسبة أو المفقودة من المادة نتيجة تغير درجة الحرارة ؟
الجواب : الحرارة النوعية تبين لنا كم جولا يفقدها أو يكتسبها كل واحد جرام من المادة لكل تغير في درجة الحرارة مقداره واحد درجة مئوية .
السؤال : صف معنى النظام في الديناميكا الحرارية ، واشرح العالقة بين النظام والمحيط والكون
الجواب : النظام هو جزء معين من الكون يحتوي على التفاعل أو العملية التي نريد دراستها ، في حين يعد المحيط كل شيء في الكون ما عدا النظام . إذا الكون هو النظام و محيطه
السؤال : احسب الحرارة النوعيةj(g/C) لمادة مجهولة ، إذ تطلق عينة كتلتها g 50.2 منها Cal 0.12
عندما تتغير درجة حرارتها من C °25 إلى C °0.20.
الجواب : نحول أولا q من وحدة Calلى وحدة J باستخدام العلاقة التالية :
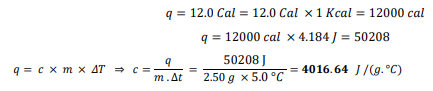
السؤال : صمم تجربة صف خطوات العمل التي يمكنك أن تتبعها لإيجاد الحرارة النوعية لقطعة فلز كتلتها g 0.45
الجواب :
1- نضع كتلة معروفة من الماء في المسعر ، ونعير درجة حرارة الماء الابتدائية .
2- نسخن عينة الفلز g 0.45 إلى 622 درجة مئوية في الماء المغلي .
3- نضع عينة الفلز الساخنة في الماء في مسعر ، وننتظر حتى تثبت درجة حرارة الماء .
4 - نعين درجة الحرارة النهائية للماء .
5- نحسب الحرارة النوعية للفلز مفترضين أن الحرارة ال تفقد من قبل الفلز إلى المحيط .
6- يمكن حساب الحرارة النوعية للمعدن عن طريق المساواة بين كمية الحرارة التي اكتسبها الماء وكمية الحرارة المفقودة بواسطة المعدن .
حل درس المعادلات الكيميائية الحرارية

مسائل تدريبية
السؤال : احسب الحرارة الالزمة لصهر g 7.25 من الميثانول الصلب عند درجة انصهاره . استعن بالجدول 4 ــ3
الجواب :

السؤال : ما كمية الحرارة المنطلقة عن تكثف g275 من غاز األمونيا إلى سائل عند درجة غليانه ؟ استعن في الجدول 4ــ3 لتحديد comb∆.
الجواب :

السؤال : تحفيز ما كتلة الميثان CH4 التي يجب احتراقها لإطلاق j𝑘 880.12 من الحرارة ؟ استعن في الجدول 2ــ3
الجواب :
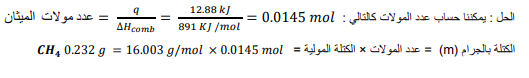
التقويم 2-3
السؤال : كتب معادلة كيميائية حرارية كاملة الحتراق اإليثانول C2H5OH إذا علمت أن 1367Kj/mo = ∆𝐻𝑐𝑜𝑚𝑏
الجواب :

السؤال : حدد أي العمليات الآتية طاردة للحرارة ، وأيها ماصة لها ؟
أ- 𝐶2𝐻5𝑂𝐻(𝑙) → 𝐶2𝐻5𝑂𝐻(𝑔)
ب- 𝐵𝑟2 . (𝑙) → 𝐵𝑟2(𝑠)
ج- 𝐶5𝐻12 . (𝑔) + 8𝑂2(𝑔) → 5𝐶𝑂2(𝑔) + 6𝐻2𝑂
الجواب : التفاعل ( a )ماص للحرارة . بينما التفاعلين ( a.b ) طاردين للحرارة .
السؤال : اشرح كيف يمكنك حساب الحرارة المنطلقة عند تجمد 0.25 mol ماء .
الجواب : نضرب0.250 mol في حرارة الانصهار لكل mol من الماء في6.01Kj/mol
السؤال : حسب كمية الحرارة المنطلقة عند احتراق g 206 من غاز الهيدروجين ؟ -286kj/mol = ∆𝐻𝑐𝑜𝑚𝑏
الجواب :

السؤال : طبق إذا كانت حرارة التبخر المولارية للأمونيا هي 23.3Kj/molفما مقدار حرارة التكثف المولارية للأمونيا ؟
الجواب : حرارة التكثف المولارية للأمونيا = -23.3Kj/mol
السؤال : تفسير الرسوم العلمية يبين الرسم المجاور المحتوى الحراري للتفاعل C → A
هل التفاعل طارد أم ماص للحرارة ؟ فسر إجابتك .
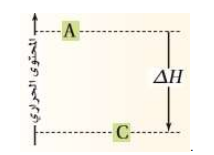
الجواب: التفاعل طارد للحرارة : لأن المحتوى الحراري للنواتج ( c )أقل من محتوى الحراري للمتفاعلات ( A. )
حل درس حساب التغير في المحتوى الحراري

مسائل تدريبية
السؤال : استعمل المعادلتين a و b لإيجاد H∆ للتفاعل الآتي :
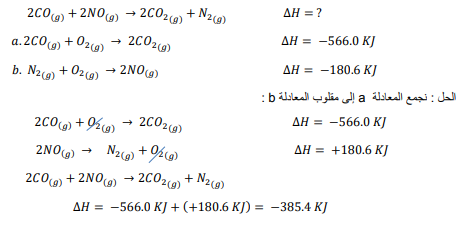
السؤال : تحفيز إذا كانت قيمة H∆ للتفاعل الآتي-1789Kj ، −فاستعمل ذلك مع المعادلة a لإيجاد H∆ للتفاعل b

مسائل تدريبية
السؤال : بين كيف أن مجموع معادالت حرارة التكوين يعطي كلامن التفاعلاتالآتية ، دون البحث عن قيم H∆ واستعمالها في الحل :

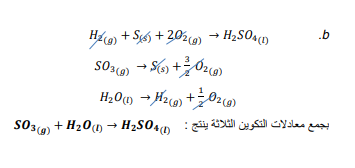
السؤال : مستعيناً بجدول قيم حرارة التكوين القياسية ، احسب H∆ للتفاعل الآتي :
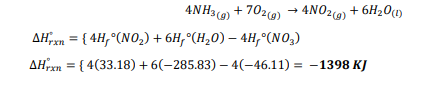
السؤال : تحفيز بدمج معادلتي حرارة التكوين a و b تحصل على معادلة تفاعل أكسيد النيتروجين مع الاكسجين ، الذي ينتج عنه ثاني أكسيد النيتروجين

التقويم
السؤال : وضح المقصود بقانون هس ، وكيف يستعمل لإيجاد H∆ ؟
الجواب : قانون هس : تغير الطاقة في تفاعل كيميائي يساوي مجموع التغيرات في طاقة التفاعلات الفردية المكونة له .
يمكن تحديد H∆ للتفاعل عن طريق اختيار المعادلات التي تحتوي على المواد الموجودة في المعادلة الشاملة ، ويتم عكس اتجاه المعادلات إذا لزم الأمر أو ضربها وضرب H∆ لها بأي عوامل ضرورية . ثم يجمع H∆ للمعادلات للحصول على القيمة الإجمالية لهذه المعادلة
السؤال : اشرح بالكلمات الصيغة التي يمكن استعمالها لإيجاد 𝑥𝑟𝐻∆ عند استعمال قانون هس .
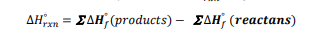
الجواب : المحتوى الحراري للتفاعل في الظروف القياسية ( ضغط جوي واحد و K298 )يساوي مجموع حرارة التكوين القياسية للنواتج مطروحاً منه مجموع حرارة التكوين القياسية للمواد المتفاعلة .
السؤال : صف كيف تعارف العناصر في حالتها القياسية على تدريج حرارة التكوين القياسية ؟
الجواب : تعطى لهم حرارة تكوين تساوي الصفر .
السؤال : تفحص البيانات في الجدول 3ــ3 . ماذا يمكن أن تستنتج عن ثبات أو استقرار المركبات المذكورة مقارنة بالعناصر في حالتها القياسية ؟
الجواب : تذكر أن الثبات أو الاستقرار يرتبط مع الطاقة المنخفضة . - لمركبات الموجودة في الجدول 2-5 جميعها أكثر ثباتاً من العناصر التي تكونت منها .
السؤال : احسب استعمل قانون هس لإيجاد H𝛥 للتفاعل أدناه : للتفاعل أدناه :
الجواب :

السؤال : تفسير الرسوم العلمية استعمل البيانات أدناه لعمل رسم لحرارة التكوين القياسية مشابه للشكل 2-14 ، واستعمله في إيجاد حرارة تبخر

حل تقويم الفصل الثاني الطاقة والتغيرات الكيميائية

إتقان المفاهيم
السؤال :قارن بين درجة الحرارة والحرارة
الجواب : الحرارة : شكل من أشكال الطاقة ، تنتقل من جسم دافئ إلى جسم أبرد ( أقل دفئاً )
درجة الحرارة : قياس لمعدل الطاقة الحركية للجسيمات الموجودة في عينة من المادة .
السؤال : كيف تتغير طاقة الوضع الكيميائية لنظام خلال تفاعل ماص للحرارة ؟
الجواب : تزداد طاقة الوضع الكيميائية
السؤال : صف تطبيقات عملية تبين فيها كيف تتغير طاقة الوضع إلى طاقة حركية ؟
الجواب : تتحول طاقة الوضع للثلج الموجود على ارتفاع أعلى في أثناء الانهيار الثلجي إلى طاقة حركية عندما يسقط الثلج إلى أسفل الجبل .
السؤال : السيارات كيف تتحول الطاقة في الجازولين ؟ وما الطاقة الناتجة عن احتراقه في محرك السيارة ؟
الجواب : يتحول بعضها إلى شغل يحرك المكابس داخل المحرك ، والكثير منها يتحول إلى حرارة .
السؤال : التغذية قارن بين السعر الغذائي و السعر . ما العالقة بين السعر الغذائي والكيلو سعر ؟
الجواب : يساوي السعر الغذائي الواحد cal 1000 أي 1cal=1000cal - في حين يساوي كل 1Cal غذائي 1Kcal
السؤال : ما الكمية التي تقاس بوحدة C.°g/J ؟
الجواب : الحرارة النوعية
السؤال : صف ما يمكن أن يحدث في الشكل 16ــ2 عندما يكون الهواء فوق سطح البحيرة أبرد من الماء .
الجواب : إذا كان الهواء باردا لدرجة كافية ، فقد يتكاثف الماء الصاعد من البحيرة مكونا الضباب و تنتقل الحرارة من الماء الادفأ إلى الهواء الأبرد و سيكون الهواء الموجود فوق الماء مباشرة أدفأ قليلا من الهواء المحيط ، و سيبدو الضباب وهو يرتفع من البحيرة كأنه بخار
السؤال : الحرارة النوعية للإيثانول هي C.°g/J 44.2 . ماذا يعني ذلك ؟
الجواب : يعني ذلك أن كمية الحرارة اللازمة لرفع درجة حرارة g1 من الإيثانول درجة سيليزية واحدة 1cهي2.44j
السؤال : شرح كيف تحدد كمية الطاقة اللازمة لرفع درجة حرارة شيء ما ؟
الجواب : كمية الحرارة المطلوبة تساوي حاصل ضرب الحرارة النوعية للجسم في كتلته في التغير في درجة الحرارة . q=c×m×T
إتقان المسائل
السؤال : التغذية يحتوي أحد أصناف الطعام على 124Cal . كم cal يوجد في هذا الصنف من الطعام ؟
الجواب :
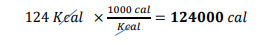
السؤال : كم جولا j من الطاقة يتم امتصاصه في عملية يمتص خاللها 0.5720Kcal من الطاقة ؟
الجواب :
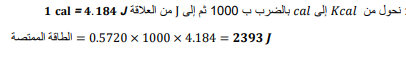
السؤال : المواصلات يستعمل الإيثانول بوصفه مادة مضافة إلى البنزين . ينتج عن احتراق 1mol من الإيثانول 1367Kj من الطاقة . ما مقدار هذه الطاقة ب Cal ؟
الجواب :
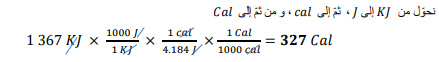
السؤال : لتبخير 2.00g من الأمونيا يلزم 656Cal من الطاقة . كم Kj تلزم لتبخير الكتلة نفسها من الامونيا ؟
الجواب :
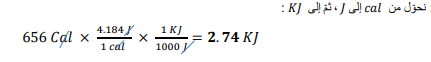
السؤال : احتراق 1mol من اإليثانول يطلق Cal 7.326 من الطاقة . ما مقدار هذه الكمية ب Kj ؟
الجواب :
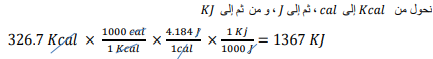
السؤال : لتعدين برغي كتلته g25 مصنوع من سبيكة امتصت j 250 من الحرارة فتغيرت درجة حرارتها منC25 إلى C 78. ما الحرارة النوعية للسبيكة ؟
الجواب :
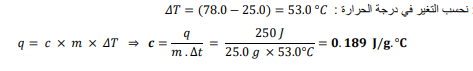
إتقان المفاهيم
السؤال : لماذا يستخدم كوب البوليسترين مسعراً بدلا من الكأس الزجاجية ؟
الجواب : لأن البوليسترين عازل حراري أفضل من الزجاج ، ولذلك تكون الحرارة المفقودة في حالة مسعر البوليسترين أقل ما يمكن .
السؤال :هل التفاعل المبين في الشكل 17ــ2 ماص أم طارد للحرارة ؟ كيف عرفت ذلك ؟
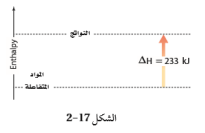
الجواب : التفاعل ماص للحرارة ، لان المحتوى الحراري للنواتج أعلى من المحتوى الحراري للمواد المتفاعلة
السؤال : اعط مثالين على أنظمة كيميائية وعرف مفهوم الكون في هذين المثالين .
الجواب : الكون =النظام +المحيط
مثال 1 : الك س الذي يحدث فيه التفاعل ( النظام )، كل شيء يحيط بالكأس ( المحيط )
مثال 2 : جسم الإنسان ( النظام ) ، كل شيء يحيط بجسم الإنسان ( المحيط)
السؤال : متى تكون كمية الحرارة ( q )الناتجة أو الممتصة في تفاعل كيميائي مساوية للتغير في المحتوى الحراري H𝛥 ؟
الجواب : عندما يتم التفاعل في وعاء معزول تحت ضغط ثابت
السؤال : إذا كانت قيمة التغير في المحتوى الحراري HΔ لتفاعل سالبة . فبم يوحي لك ذلك عن الطاقة الكامنة الكيميائية للنظام قبل التفاعل وبعده ؟
الجواب : إن الطاقة الكيميائية الكامنة قبل التفاعل أكبر منها بعد التفاعل حيث أنها تحولت إلى طاقة حرارية ف صبحت النواتج أقل طاقة من المتفاعالت .
السؤال : ما إشارة HΔ لتفاعل طارد للحرارة ؟ ولتفاعل ماص للحرارة ؟
الجواب : HΔ لتفاعل طارد للحرارة تكون إشارتها سالبة
HΔ لتفاعل ماص للحرارة تكون إشارتها موجبة .
إتقان حل المسائل
السؤال : كم جول من الحرارة تفقدها 3580 Kg من الجرانيت عندما تبرد درجة حرارتها من 41.2 إلى -12.9؟ الحرارة النوعية للجرانيب هي 0.803j/gC
الجواب :
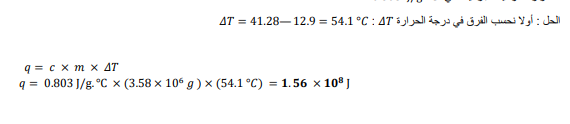
السؤال : حوض السباحة ملئ حوض سباحة 20m×12.5m بالماء إلى عمق m 75.3 . إذا كانت درجة حرارة ماء الحوض الابتدائية C°4.18 ، ما كمية الحرارة الالزمة لرفع درجة حرارته إلى C° 0.29 ؟ كثافة الماء هي 1.00g/ml
الجواب : لحساب كتلة الماء : نحسب حجم الماء
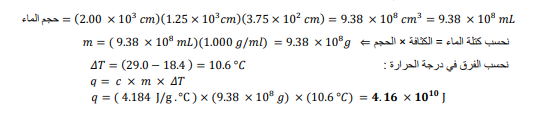
السؤال : ما كمية الحرارة التي تمتصها قطعة رصاص كتلتها 44.7 إذا ازدادت درجة حرارتها بمقدار 65.4
الجواب :
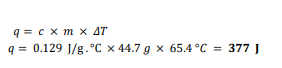
السؤال : إعداد الطعام وضع g 2.10 من زيت الكانولا في مقالة ، ولزم kJ34.3 لرفع درجة حرارته من 0.25 إلى 196.4. ما الحرارة النوعية لزيت الكانولا ؟
الجواب :
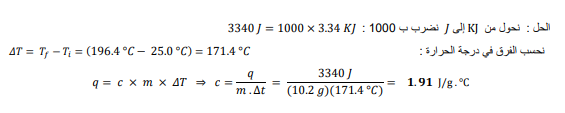
السؤال : السبائك إذا وضعت سبيكة كتلتها 58.8g في g 125 من الماء البارد في مسعر ، فنقصت درجة حرارة السبيكة بمقدار 1.106، بينما ارتفت درجة حرارة الماء 5.10 ، فما الحرارة النوعية للسبيكة ؟
الجواب : كمية الحرارة المكتسبة للماء = كمية الحرارة المفقودة من السبيكة ⇐ (السبيكة) (الماء)q
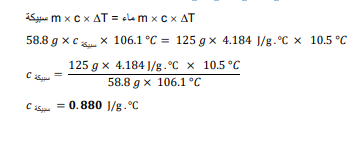
إتقان المفاهيم
السؤال : حرارة االنصهار الموالرية للميثانول هي 3.22 Kj/mol . ماذا يعني ذلك ؟
الجواب :هذا يعني أن الحرارة االلازمة لصهر 1mol من الايثانول = 3.22Kj
السؤال : اكتب المعادلة الكيميائية الحرارية لاحتراق الميثان .
الجواب :
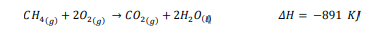
إتقان حل المسائل
السؤال : استعن بالمعلومات الواردة في الشكل 18ــ2 لحساب كمية الحرارة اللازمة لتبخر 4.33mol من الماء عند درجة حرارة 100c
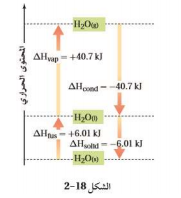
الجواب :

السؤال : الشواء ما كتلة البروبان C3H8التي يجب حرقها في مشواة لكي تطلق Kj 4560 من الحرارة ؟
الجواب :
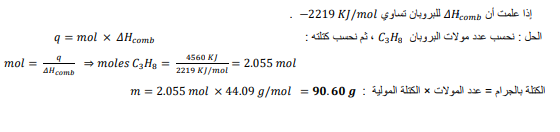
السؤال : التدفئة باستعمال الفحم ما كمية الحرارة التي تنطلق عند احتراق 5.0Kg من الفحم إذا كانت نسبة كتلة الكربون فيه % 2.96 والمواد الأخرى التي يحتويها الفحم ال تتفاعل ؟

السؤال : ما كمية الحرارة المنطلقة من تكثف g1255 بخارالماء إلى ماء سائل عند درجة حرارة C 100 ؟
الجواب : نحسب عدد مولات بخار الماء ، ثم نحسب الحرارة المنطلقة :

السؤال : إذا أطلقت عينة من الأمونيا 5.66Kj من الحرارة عندما تصلبت عند درجة انصهارها . فما كتلة العينة ؟
الجواب : الكتلة = كتلة 1 mol من NH3=17.03g
إتقان المفاهيم
السؤال : بم تصف حرارة التكوين القياسية لمركب معين ؟
الجواب : تتصف حرارة التكوين القياسية التغير في محتوى الطاقة ، عندما يتكون مول واحد من المركب في الظروف القياسية من عناصره في حالاتها القياسية .
السؤال : كيف تتغير ΔH في معادلة كيميائية حرارية إذا تضاعفت كميات المواد جميعها ثلاث مرات وعكست المعادلة ؟
الجواب : تتضاعف قيمة H𝛥 ثالث مرات وتتغير إشارة H𝛥
إتقان حل المسائل
السؤال : حساب القياسية التكوين حرارة استعمل
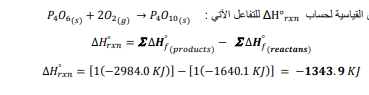
السؤال : استعمل قانون هس والمعادلتين الكيميائيتين الحراريتين الآتيتين لإيجاد المعادلة الكيميائية الحراري للتفاعل :

مراجعة عامة
السؤال : إذا أردت أن تحفظ الشاي ساخناً فإنك تضعه في ترمس . وضح لماذا قد تغسل الترمس بالماء الساخن قبل حفظ الشاي الساخن به ؟
الجواب : سينقل الماء الساخن جزءاً من الطاقة إلى الترمس ويرفع درجة حرارته . ولذلك فإن الشاي لن يفقد الكثير من حرارته عند وضعه داخل الترمس.
السؤال : فرق بين حرارة تكوين H2O و H2O لماذا من الضروري تحديد الحالة الفيزيائية للماء في المعادلة الكيميائية الحرارية الآتية :
𝐶𝐻4(𝑔) + 2𝑂2(𝑔) → 𝐶𝑂2(𝑔) + 2𝐻2𝑂(𝑙) 𝛥𝐻
الجواب :
حرارة تكوينH2O هي التغير في المحتوى الحراري الذي يرافقه تكوين مول واحد من الماء السائل
حرارة تكوين H2Oهي التغير في المحتوى الحراري الذي يرافقه تكوين مول واحد من بخار الماء .
وتختلف العملية التي يتكون عندها الماء السائل عن تلك التي يتكون عندها بخار الماء ولذلك يتغير المحتوى الحراري أو حرارة التكوين لكل من 𝐻2𝑂(𝑙) 𝐻2𝑂 ، (𝑔) والبد من تحديد الحالة الفيزيائية للماء في هذه المعادلة حتى نستطيع حساب التغير في المحتوى الحراري للمعادلة الناتجة.
السؤال : استعمل قانون هس والتغيرات في المحتوى الحراري للتفاعلين الآتيين لحساب H𝛥 للتفاعل :
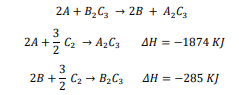
الجواب : نعكس المعادلة الثانية ونغير إشارة H𝛥 لها ، ثم نجمعها مع المعادلة الاولى ، ونجمع قيمتي 𝛥H لهما لنحصل على المعادلة النهائية :
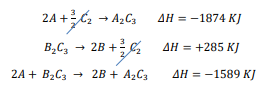
التفكير الناقد
السؤال : طبق يعد ثالث كلوريد الفوسفور مادة أولية في تحضير مركبات الفوسفور العضوية . بين كيف يمكن استعمال المعادلتين الحراريتين a و b لتحديد التغير في المحتوى الحراري للتفاعل :
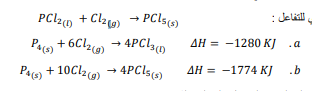
الجواب : نعكس المعادلة a ، ونقسمها على العدد 4 لنحصل على المعادلة c. كما نقسم المعادلة b على 4 لنحصل على المعادلة d .
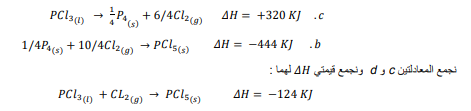
السؤال : توقع أي المركبين : غاز الميثان 4 𝐶𝐻وبخار الميثانال CH2Oله حرارة احتراق أكبر ؟ وضح إجابتك . ( ملاحظة : اكتب وقارن المعادلتين الكيميائيتين الموزونتين لتفاعلي الاحتراق لكل منهما )
الجواب :
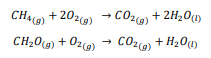
الجواب : بدو أن الميثان له حرارة احتراق مولارية أكبر ، حيث تظهر المعادلتان في أعلاه أن احتراق مول واحد من غاز المثان يُنتج مولا واحداً من غاز ثاني أكسيد الكربون ، ومولين اثنين من الماء ، في حين يُنتج احتراق مول واحد من غاز الميثانال مولا واحداً من الماء . وبما أن المحتوى الحراري لنواتج احتراق غاز الميثان قيمة أكبر ، سيبدو أن الميثان له حرارة احتراق مولارية أكبر من الميثانال
مسألة تحد
السؤال : حللت عينة من الغاز الطبيعي فوجد أنها تتكون من %4.88 ميثان 4 𝐶𝐻و %6.11 إيثان C2H6
إذا كانت حرارة الاحتراق القياسية للميثان هي-891Kj/molوينتج عن احتراقه غاز ثاني أكسيد الكربون 2 𝐶𝑂وماء سائل H2O اكتب معادلة احتراق غاز الإيثان مكونا وين القياسية ثاني أكسيد الكربون والماء ، ثم احسب حرارة الاحتراق القياسية للإيثان مستعملا حرارة التكوين استعمل النتيجة وحرارة الاحتراق القياسية للميثان من الجدول 3ــ2 ، في حساب الطاقة المنطلقة عن احتراق 1Kg من الغاز الطبيعي .
الجواب : نكتب المعادلة الكيميائية الموزونة

مراجعة تراكمية
السؤال :ما هو التركيز المولاري لمحلول تم تحضيره بإذابة g 0.25 من ثيوسيانات الصوديوم ( NaSCN)في كمية كافية من الماء لعمل 500ML من المحلول ؟
الجواب :

السؤال : عدد ثلاث خصائص جامعة للمحاليل .
الجواب : الانخفاض في الضغط البخاري ، الارتفاع في درجة الغليان ، الارتفاع في درجة التجمد
تقويم إضافي
الكتابة في الكيمياء
السؤال : الوقود البديل ابحث كم خلال المصادر وشبكة الإنترنت حول كيف يمكن إنتاج الهيدروجين وشحنه واستعماله وقوداً وقوداً بديلا لخص فوائد وعوائق استعمال الهيدروجين في محركات الاحتراق الداخلي
الجواب : يمكن استعمال الهيدروجين وقوداً في سيارات خلايا الوقود . ويمكن تكييف التقنية المستعملة حالياً للتعامل مع غازي الميثان و البروبان لاستعمالهما مع الهيدروجين ، إذ يعد معظم الهيدروجين المتوافر حاليا في صناعة البتروكيماويات . وإذا اردنا استعمال الهيدروجين وقودا للسيارات و الاحتياجات الاخرى للطاقة على نطاق واسع فمن المحتمل إنتاجه بالتحليل الكهربائي للماء ، وباستعمال مصادر الطاقة المتجددة كطاقة الرياح والطاقة الشمسية .فالناتج الوحيد لاحتراق الهيدروجين هو الماء ، لذا فإنه يُعد من مصادر الطاقة غير الملوثة للبيئة
أسئلة المستندات
زيت الطبخ قامت مجموعة بحث جامعية بحرق أربعة أنواع من زيوت الطبخ في مسعر لتحديد ما إذا كان هناك علاقة بين حرارة الاحتراق وعدد الروابط الثنائية في جزيء الزيت . تحتوي زيوت الطبخ على سلاسل طويلة من ذرات الكربون التي ترتبط بروابط مفردة أو ثنائية . السلسلة التي لا تحتوي على روابط ثنائية تسمى المشبعة . والزيوت التي تحتوي على رابطة ثنائية أو أكثر تسمى غير مشبعة . حرارة الاحتراق للزيوت الأربعة موجودة في الجدول 2-6 . حسب الباحثون انحراف النتائج فوجدوا أنها % 6.0 ، واستنتجوا أنه لا يمكن تحري أي علاقة بين التشبع وحرارة الاحتراق بالطريقة المختبرية المستعملة .
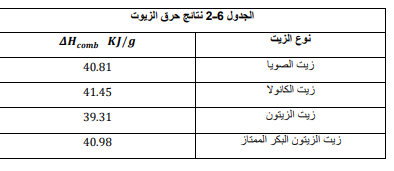
السؤال : أي الزيوت أعطى أكبر كمية من الحرارة لكل وحدة كتلة عند احتراقه ؟
الجواب : زيت الكانولا : 14.45 Kj/g
السؤال : ما مقدار الحرارة التي قد تنطلق عند حرق 0.554Kg من زيت الزيتون ؟
الجواب
نحول من Kg إلى g بالضرب في 1000 = 554kg = 0.554kg
39.31kj/g× 554g= 21777kj= كمية الحرارة الناتجة عند حرق زيت الزيتون
السؤال : افترض أنه عند حرق g 2.2 من زيت الصويا استعملت الطاقة الناتجة جميعها في تسخين 1.600kg من الماء الذي درجة حرارته الأولية 20.0C. ما درجة الحرارة النهائية للماء ؟
الجواب :

حل اختبار مقنن الفصل الثاني الطاقة والتغيرات الكيميائية

أسئلة الاختيار من متعدد
السؤال : الحرارة النوعيةللإيثانول تساوي 22.4J/Cما الطاقة ( KJ )اللازمة لتسخين g 50 من الإيثانول من درجة حرارة 20.0 إلى 68.0
أ- 10.7 KJ
ب- 8.30KJ
ج- 2.44KJ
د- 5.86KJ
الجواب :

السؤال : إذا سُخنت رقاقة لأومنيوم كتلتها g3.00 في فرن ، فارتفعت درجة حرارتها من 20.0C إلى 662.0C ، وامتصت J 1728 من الحرارة ، فما الحرارة النوعية للألومنيوم ؟
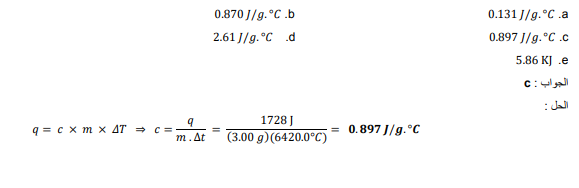
السؤال : يسمى التغير في المحتوى الحراري الذي يرافق تكون مول واحد من المركب في الظروف القياسية من عناصره في حالاتها القياسية :
a .حرارة الاحتراق
b .حرارة التبخر المولارية
c .حرارة االنصهار المولارية
d .حرارة التكوين القياسية
e .قانون هس
الجواب الصحيح : d .حرارة التكوين القياسية
السؤال : عدد تأكسد العنصر Q يساوي 2 ، +وعددت تأكسد العنصر Mيساوي 3- ما الصيغة الصحيحة للمركب الناتج عن Q و M ؟
𝑄2𝑀3 .a
𝑀2𝑄3 .b
𝑄3𝑀2 .c
𝑀3𝑄2 .d
الجواب الصحيح : 𝑄3𝑀2 .c
ادرس العبارات التالية :
العبارة الأولى : تحتوي المعادلة الكيميائية الحراري على الحالات الفيزيائية للمواد المتفاعلة والمواد الناتجة ، كما تبين التغير في المحتوى الحراري .
العبارة الثانية : حرارة التبخر المولارية هي كمية الطاقة اللازمة لصهر مول واحد من المادة
العبارة الثالثة : الحرارة التي يفقدها أو يكتسبها النظام خلال تفاعل أو عملية تتم عند ضغط ثابت تسمى التغير في المحتوى الحراري H𝛥 . أي العبارات أعلاه صحيحة :
a .الأولى والثانية
b .الأولى والثالثة .
c .الثانية والثالثة
d .الأولى والثانية والثالثة .
الجواب الصحيح : b .الأولى والثالثة .
استعمل الرسم البياني ادناه للإجابة عن السؤال التالي :

السؤال : ما الضغط المتوقع للغاز B عند K 310 ؟
أ- 500KPa
ب- 600KPa
ج- 700Kpa
د- 900KPa
الجواب الصحيح : 600KPa
السؤال : وضعت كمية من الماء درجة حرارته C 60.25 في مسعر ، ثم سخنت قطعة من الحديد كتلتها g 50.0 حتى أصبحت درجة حرارتها115.0 ، ووضعت في الماء الموجود بالمسعر ، وبعد التبادل الحراري بين الماء وقطعة الحديد أصبحت درجة الحرارة النهائية لمحتويات المسعر 29.30 ، وكانت كمية الحرارة التي امتصها الماء J 1940 ما كتلة الماء ؟
أ- 50.0g
ب- 125g
ج- 358960g
د- 143.56g
الجواب الصحيح : ب- 125g
أسئلة الإجابات القصيرة
السؤال : اكتب إشارة H𝛥 لكل من تغيرات الحالة الفيزيائية الآتية
أ- 𝐶2𝐻5𝑂𝐻(𝑠) → 𝐶2𝐻5𝑂𝐻
ب- H2𝑂(𝑔) → H2𝑂
ج- 𝐶𝐻3𝑂𝐻(𝑙) → 𝐶𝐻3𝑂𝐻
د- 𝑁𝐻3 .(𝑙) → 𝑁𝐻3(𝑠)
الجواب :
a .موجبة
b.سالبة
c .موجبة
d .سالبة
السؤال : زودت عينة من الماء بالحرارة بصورة ثابتة لإنتاج منحنى التسخين في الشكل أدناه . حدد ما ذا يحدث في المقاطع 4 ، 5 ، 2 ، 1 الموضحة على المنحنى ؟
الجواب :

لمقطع 1 : يكون الماء في الحالة الصلبة ويمتص كمية من الحرارة حتى يصل إلى درجة الصفر سيليزيوس .
المقطع 2 : يستهلك الماء كمية الحرارة الممتصة ليتحول من الحالة الصلبة إلى السائلة وتظل درجة حرارة الماء ثابتة .
المقطع 3 : تزداد درجة حرارة الماء بزيادة كمية الطاقة الممتصة .
المقطع 4 : تزداد كمية الطاقة التي يمتصها الماء ولكن تثبت درجة حرارته ألن هذه الطاقة مستهلكة في تحول الماء من الحالة السائلة إلى الحالة الغازي
أسئلة الإجابات المفتوحة
السؤال : يرش الماء على البرتقال في ليلة باردة . إذا كان متوسط ما يتجمد من الماء على كل برتقالة g 8.11 فما كمية الحرارة المنطلقة ؟
الجواب : نحسب عدد مولات H2Oثم نحسب الحرارة المنطلقة
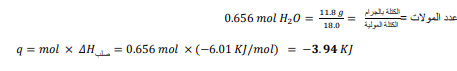
السؤال : شرح كيف يساد التعرق على تبريد جسمك ؟
الجواب : يبرد الجسم ، لأن التعرق يزوده بالحرارة اللازمة لتبخير الماء عن الجلد ، فترتفع درجة الحرارة ، فيتبخر العرق مخفضاً درجة حرارة الجلد ، فيبرد الجسم .









