حل الذرة فيزياء 3
مسائل تدريبية ص140
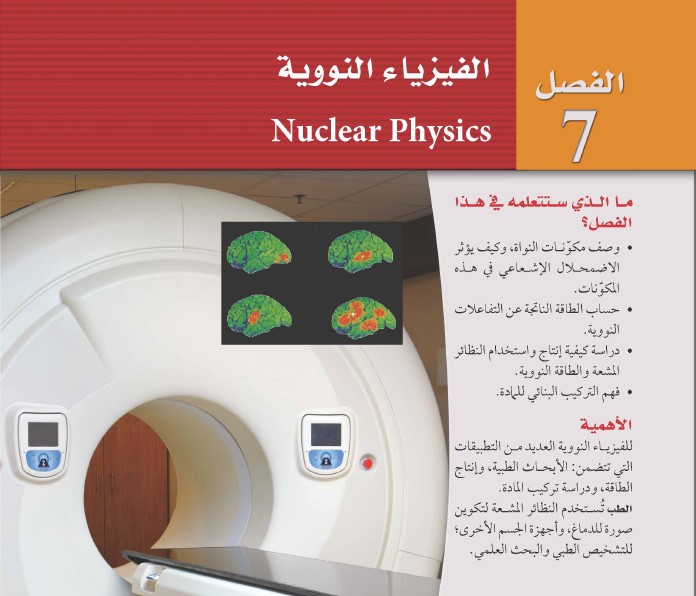
السؤال : احسب طاقة المستويات التالية لذرة الهيدروجين : الثاني والثالث والرابع .
الجواب :
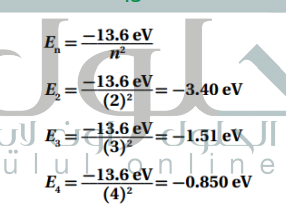
السؤال : احسب فرق الطاقة بين مستوى الطاقة E3 ومستوى الطاقة E2 في ذرة الهيدروجين
الجواب :
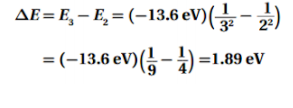
السؤال :احسب فرق الطاقة بين مستوى الطاقة E4 و مستوى الطاقة E2 في ذرة الهيدروجين .
الجواب :
السؤال : النص الىتي يمثل حل المعادلة rn= h2n2 /4 π2 Kmq2 عندما n=1 ، فإن نصف القطر يكون هو الأصغر لمستويات ذرة الهيدروجين . لاحظ أنه – ما n2 – فإن كل المعطيات الأخرى في المعادلة ثابتة . و r1 تساوي 5.3 x10-11 m ، أو 0.053 nm . استخدام هذه المعلومات في حساب أنصاف أقطار مستويات الطاقة الثاني والثالث والرابع في ذرة الهيدروجين .
الجواب :

السؤال : قطر نواة ذرة الهيدروجين 2.5x10-15 m ، والمسافة بين النواة والإلكترون الأول 5x10-11 m تقريبا . إذا استخدمت كرة قطرها 7.5 cm لتمثل النواة ، فكم يكون بعد الإلكترون ؟
الجواب :

مسائل تدريبية ص141
السؤال : أوجد الطول الموجي للضوء المنبعث في المسائل 2 و 3 أي خطوط في الشكل 5-8 ترتبط مع كل عملية انتقال ؟
الجواب :

السؤال : في عملية انتقال محدد ، تسقط طاقة ذرة الزئبق من مستوى طاقة 8.82 eV إلى مستوى طاقة 6.67 eV .
a. ما مقدار طاقة الفوتون المنبعث من ذرة الزئبق ؟
الجواب :

b. ما مقدار الطول الموجي للفوتون المنبعث من ذرة الزئبق ؟
الجواب :
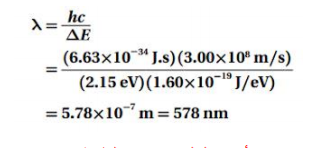
السؤال : في حالة استقرار أيون الهليوم تكون الطاقة -54.4 eV . ولكي يتم التحول إلى حالة الاستقرار انبعث فوتون طوله الموجي 304 nm. ما مقدار طاقة الإثارة ؟
الجواب :

مراجعة ص142
السؤال : نموذج راذرفورد النووي : لخص تركيب الذرة بناء على نموذج راذرفورد النووي .
الجواب :وفق النموذج النووي لراذرفورد ، فإن جميع الذرات موجبة الشحنة ومعظم كتلتها في النواة الصغيرة الواقعة في مركز الذرة حيث تدور حولها إلكترونات سالبة الشحنة .
السؤال : الأطياف : فيبم تختلف أطياف الانبعاث الذرية للمواد الصلبة المتوهجة والغازات ، وفيم تتشابه ؟
الجواب : المواد الصلبة المتوهجة تنتج حزمة متصلة من الألوان ، في حين تنتج الغازات مجموعة من الخطوط الطيفية المنفصلة . وتتكون جميع الأطياف نتيجة تحولات في مستوى الطاقة في الذرة .
السؤال : نموذج بور : فسر كيف تحفظ الطاقة عندما تمتص ذرة فوتون الضوء ؟
الجواب : يكون المجموع الأولي لطاقة الإلكترونات في الذرة مضافا إليها طاقة الفوتون الممتص تساوي الطاقة النهائية للإلكترون في الذرة .
السؤال : نصف قطر المستوى : يسلك أيون الهليوم سلوك ذرة الهيدروجين ، ونصف قطر مستوى طاقة الأيون الأدنى يساوي 0.0265 nm . اعتمادا على نموذج بور ، ما مقدار نصف قطر مستوى الطاقة الثاني ؟
الجواب : يعتمد نصف قطر مستوى الإلكترون على n2 ، لذلك فإن r2 =4r1
=0.106 nm
السؤال : طيف الامتصاص : وضح كيفية حساب طيف الامتصاص لغاز ما . وضح أسباب ظهور الطيف .
الجواب : ينفذ الضوء الأبيض من خلال عينة من الغاز ثم من خلال جهاز سبكتروسكوب . و لأن الغاز يمتص أطوالا موجية محددة فإن الطيف المستمر العادي يحتوي على خطوط معتمة .
السؤال : نموذج بور : تم الكشف عن تحول ذرة الهيدروجين من مستوى الطاقة 101 إلى مستوى الطاقة 100 . ما مقدار الطول الموجي للإشعاع ؟ أين يقع هذا الانبعاث في الطيف الكهرومغناطيسي ؟
الجواب :

السؤال : التفكير الناقد نصف قطر نواة ذرة الهيدروجين 1.5x10-15 m تقريبا . إذا كنت راغبا في بناء نموذج لذرة الهيدروجين باستخدام كرة بلاستيك r= 5 cm لتمثيل النواة فأين تضع إلكترونا في مستوى n=1 ؟ هل يكون موقعه في غرفة صفك ؟
الجواب :

مراجعة
السؤال : أجهزة الليزر أي أجهزة الليزر في الجدول 5-1 تبعث ضوءا احمرارا ( ضوءا مرئيا ذا طول موجي كبير ) ، وأيها يبعث ضوءا أزرق ، وأيها يبعث حزما ضوئية لا يمكن رؤيتها بالعين ؟
الجواب :
ليزر GaALAs يبعث ضوءا أكثر احمرارا .
ليزر Ar+ و InGaN يبعث ضوءا أزرق .
ليزر KrF و N2و GaAs و Nd و Co2 يبعث حزما ضوئية لا يمكن رؤيتها بالعين .
السؤال : ضخ الذرات وضح ما إذا كان يمكن استخدام الضوء الأخضر لضخ ضوء ليزر أحمر . لماذا لا يستخدم الضوء الأحمر لضخ الضوء الأخضر ؟
الجواب : نعم ، يمكن استخدام الضوء الأخضر لضخ ضوء ليزر أحمر ، ولكن لا يستخدم الضوء الأحمر لضخ الضوء الأخضر لأن للفوتونات الحمراء طاقة أقل من طاقة الفوتونات الخضراء ، أي ليس للفوتونات الحمراء طاقة كافية حتى تبعث فوتونات خضراء من الذرات .
السؤال : محددات نموذج بور ما أوجه القصور في نموذج بور ، على الرغم من توقعه سلوك ذرة الهيدروجين بدقة ؟
الجواب :لأنه يستطيع فقط ان يتوقع سلوك ذرات الهيليوم أو الذرات القريبة من الهيدروجين ، في حين لا يستطيع أن يفسر لماذا لا تطبق القوانين الكهربائية داخل الذرات .
السؤال : النموذج الكمي وضح لماذا تعارض نموذج بور للذرة مع مبدأ عدم التحديد لهيزنبرج ، بينما لم يتعارض النموذج معه .
الجواب: وفق مبدأ عدم التحديد لا يمكن أن تحدد موضع الجسيم وزخمه بدقة في الوقت نفسه ، مثل مدار بور . في حين يتنبأ النموذج الكمي فقط باحتمالية أن نصف قطر مستوى الإلكترون سوف يكون له قيمة ما معطاة .
السؤال : أجهزة الليزر وضح كيف يعمل ليزر الانبعاث المحفز على إنتاج ضوء مترابط .
الجواب :عندما يصطدم الفوتون بذرة مستقرة فإنه يحفز ذرة مثارة لبعث فوتون بالطاقة نفسها بالتزامن مع الفوتون المسبب ، ويبقى الفوتون المسبب دون تغير . وهذان الفوتونان يصطدمان بذرات أخرى وهكذا تنتج حزمة ضوء مترابط وتزداد أكثر فأكثر في الخطوة نفسها .
السؤال :ضوء الليزر ما الخصائص الأربعة لضوء الليزر التي تجعله مفيدا ؟
الجواب : ضوء مركز ذو طاقة كبيرة ، وموجه ، وذو طول موجي موحد ، ومترابط .
السؤال : التفكير الناقد افترض أنه تم الحصول على سحابة صغيرة جدا من الإلكترونات ، بحيث تكون الذرة بحجم النواة تقريبا . استخدم مبدأ عدم التحديد لهيزنبرج لتوضيح لماذا تستهلك كمية هائلة من الطاقة في هذه الحالة .
الجواب : السحابة الأصغر تعني معرفتنا بدقة أكبر لموقع الإلكترون ، إذا كان موقع الجسيم محددا بدقة فإن زخمه الخطي كبيرا ، لذلك فإن الطاقة الحركية للإلكترون يجب ان تكون كبيرة أيضا ، مما يتطلب طاقة كبيرة .
الفصل 5 التقويم
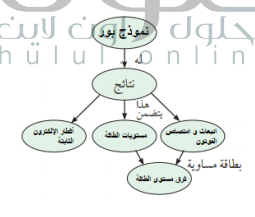
خريطة المفاهيم
السؤال : أكمل خريطة المفاهيم التالية مستخدما ما يلي :
مستوايات الطاقة ، أقطار الإلكترون الثابتة ، نموذج بور ، انبعاث وامتصاص الفوتون ، فرق مستوى الطاقة
الجواب :
إتقان المفاهيم
السؤال :وضح كيف حدد راذرفورد أن الشحنة الموجبة في الذرة متركزة في منطقة صغيرة جدا ، وليست منتشرة في الذرة .
الجواب : وجه رذرفورد شعاع من جسيمات ألفا في اتجاه صفيحة فلزية رقيقة وقاس عدد الجسيمات المنحرفة بزاويا مختلفة . فوجد أن عددا ضغيرا انحرف بزوايا كبيرة مما يدل على أمر هام ألا و هو أن الشحنة الموجبة في الذرة متمركزة في منطقة صغيرة جدا هي النواة .
السؤال : كيف فسر نموذج بور لماذا يتضمن طيف الامتصاص للهيدروجين نفس ترددات طيف الانبعاث ؟
الجواب :أن طاقة الفوتون المنبعث أو الفوتون الممتص تساوي التغير في الطاقة والتي يمكن لها قيم محددة .
السؤال : راجع نموذج الكواكب للذرة . ما المشكلات المتعلقة بهذا النموذج ؟
الجواب : عندما تخضع الإلكترونات لتسارع مركزي ، فإنها سوف تخسر طاقة فعندئذ تتخذ مسارا حلزونيا نحو النواة ، وتشع طاقة بجميع الأطوال الموجية وليست ذات أطوال موجية محددة .
السؤال : حلل وانتقد نموذج بور للذرة . ما الافتراضات الثلاثة التي قدمها بور لتطوير نموذجه ؟
الجواب : تكون مستويات الطاقة في الحالات المستقرة مكممة ، تبعث الذرة أو تمتص الإشعاع فقط عندما تتغير حالتها ، الزخم الزاوي مكمم .
السؤال : أنابيب الغاز المفرغة وضح كيف تنتج الأطياف الخطية في أنابيب الغاز المفرغة ؟
الجواب : تنتقل الطاقة إلى الغاز ، مما يسبب إثارة الإلكترونات ، فتنتقل إلى مستويات طاقة أعلى . ثم تتخلص الإلكترونات من فرق الطاقة بين مستويات الطاقة عندما تسقط عائدة على المستوى الأقل إثارة . وترتبط فروق الطاقة بين المستويات مع الخطوط الطيفية .
السؤال : كيف قدم نموذج بور تفسيرا للطيف المنبعث من الذرات من الذرات ؟
الجواب : تحدد الأطوال الموجية للفوتون بالفرق بين طاقات المستويات المسموح بها عندما ينتقل الإلكترون من مستوى الإثارة إلى مستوى الاستقرار .
السؤال : فسر لماذا تختلف الأطياف الخطية الناتجة عن أنابيب التفريغ لغاز الهيدروجين عن تلك الأطياف الناتجة عن أنابيب التفريغ لغاز الهيليوم .
الجواب : لأن تكوين كل عنصر مختلف عن الآخر من حيث توزيع الإلكترونات أو مستويات الطاقة .
السؤال : الليزرات إن مصدر طاقة جهاز الليزر المختبي (8x10-4 W) 0.8 mW فقط . لماذا يبدو أنه اكثر قدرة من ضوء مصباح كهربائي 100 W ؟
الجواب :لأن ضوء الليزر يتركز في حزمة ضيقة ، بدلا من أن ينتشر على مساحة واسعة كما في المصباح .
جهاز مشابه لليزر ينبعث إشعاع موجات ميكروويف يسمى الميزر .
السؤال : ما الكلمات المرجعية التي تكون هذا الاختصار ؟
الجواب : تضخيم الموجات الميكروية باستعمال الانبعاث المحفز بالإشعاع .
السؤال : ما خصائص ضوء الليزر التي أدت إلى استخدامه في أجهزة العرض الضوئية ؟
الجواب : الليزر موجات ضوئية موجهة ومركزة وذات أطوال موجية موحدة و أحادية اللون .
تطبيق المفاهيم
السؤال : يختلف مستوى التعقيد لمستويات الطاقة من ذرة إلى أخرى . كيف تتوقع أن يؤثر ذلك في الأطياف التي تنتجها ؟
الجواب : تصبح الأطياف أكثر تعقيدا .
السؤال : الأضواء الأضواء الشمالية تحدث الأضواء الشمالية بواسطة جسيمات ذات طاقة عالية قادمة من الشمس عندما تصطدم بذرات في الغلاف الغازي للأرض . إذا نظرت إلى هذه الأضواء بمناظر طيفي فهل تشاهد طيفا متصلا ، أم طيفا خطيا ؟ فسر .
الجواب : أشاهد طيفا خطيا لأن الضوء القادم من الغاز مكون من عناصر محددة .
السؤال : إذا انبعث ضوء أبيض من سطح الأرض وشاهده شخص من الفضاء ، فهل يظهر الطيف بحيث يكون متصلا ؟ فسر .
الجواب : لا ، طاقات معينة سوف تمتص بواسطة الغازات في الغلاف الغازي ، لذلك سوف يحتوي الطيف على خطوط امتصاص .
السؤال : هل تعد قطع النقود مثالا جيدا للتكمية ؟ هل يعد الماء كذلك ؟ فسر .
الجواب : نعم ، تأتي النقود بقيم محددة ، في حين لا يأتي الماء بأي كمية محددة محتملة .
السؤال : ذرة لها أربعة مستويات للطاقة ، E4 مستوى الطاقة الأعلى ، و E1 مستوى الطاقة الأدنى . إذا حدثت انتقالات بين أي مستويين للطاقة ، فما عدد الخطوط الطيفية التي تستطيع الذرة أن تبعث بها ؟ وما الانتقال الذي يبعث فوتونا بأعلى طاقة ؟
الجواب : تستطيع الذرة أن تبعث ستة خطوط محتملة ، والفوتون ذو الطاقة الأعلى ينتج فقط بين المستويين E4 à E1 .
السؤال : من الشكل 5-21 ، يدخل فوتون طاقته 6.2 eV ذرة زئبق في حالة استقرار . هل تمتصه الذرة ؟ فسر
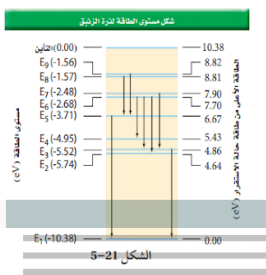
الجواب :لا ، لأنها تحتاج إلى طاقة 5.43 eV لنقل الغلكترون إلى مستوى الطاقة E5 . حيث تمتص الذرة فقط الفوتونات التي لها طاقة محددة فقط .
السؤال : ينبعث فوتون عندما ينتقل إلكترون ذرة الهيدروجين المثارة خلال مستويات طاقة أدنى . ما مقدار الطاقة العظمى التي يمكن أن تكون للفوتون ؟ وإذا منحت كمية الطاقة هذه لذرة في حالة الاستقرار ، فما الذي يحدث ؟
الجواب : الطاقة العظمى 13.6 eV وهذه أيضا طاقة التأين لذرة الهيدروجين . حيث يغادر الإلكترون النواة .
السؤال : قارن بين نظرية الكم الميكانيكية للذرة ونموذج بور .
الجواب : لنموذج بور أقطار محددة ثابتة ويسمح بالحسابات فقط لذرات الهيدروجين ، في حين يعطي النموذج الحالي ( نظرية الكم الميكانيكية ) احتمالية وجود إلكترون في موقع ما ، ويمكن أن يستخدم لجميع الذرات .
السؤال : أي الليزرات – الأحمر أو الأخضر أو الأزرق – ينتج فوتونات طاقتها أكبر ؟
الجواب : ليزر الضوء الأزرق .
إتقان حل المسائل
5-1 نموذج بور الذري
السؤال : ينتقل إلكترون ذرة كالسيوم من مستوى طاقة 5.16 eV فوق مستوى الاستقرار إلى مستوى طاقته 2.93 eV فوق مستوى الاستقرار . ما الطول الموجي للفوتون المنبعث ؟
الجواب :
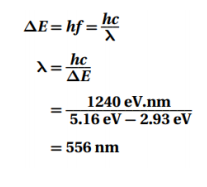
السؤال : إذا دخل فوتون ضوء برتقالي طوله الموجي 6.00x102 nm في ذرة كالسيوم مثارة عند مستوى الطاقة E6 فتأينت الذرة ، فما مقدار طاقة حركة الغلكترون المنبعث من الذرة ؟
الجواب :

السؤال : ذرة كالسيوم مثارة إلى مستوى طاقة E2 طاقته 2.93 eV فوق مستوى الاستقرار . اصطدام بها فوتون طاقته 1.20 eV فامتصته . إلى أي مستوى طاقة تنتقل ذرة الكالسيوم ؟ ارجع إلى الشكل 5-22
الجواب :
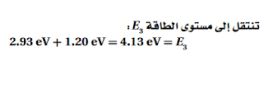
السؤال : ذرة كالسيوم مثارة عند مستوى طاقة E6 . ما مقدار الطاقة المحررة عندما تسقط الذرة إلى مستوى الطاقة E2 ؟ ارجع إلى الشكل 5-22
الجواب :
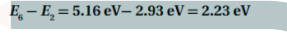
السؤال : احسب الطاقة المرتبطة بمستويات الطاقة E7 و E2 للذرة الهيدروجين .
الجواب :
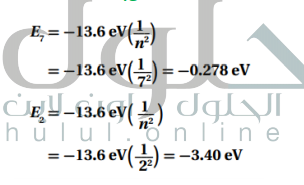
السؤال : احسب الفرق في مستويات الطاقة في المسألة السابقة .
الجواب :
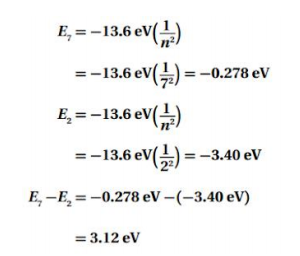
ارجع إلى الشكل 5-21 لحل المسألتين 49 و 50 .
السؤال : ذرة زئبق مثارة عند مستوى طاقة E6 .
a. ما مقدار الطاقة اللازمة لتأيين الذرة ؟
b. ما مقدار الطاقة المتحررة عندما تسقط الذرة إلى مستوى الطاقة E2؟
الجواب :

السؤال : ذرة زئبق مثارة طاقتها -4.95 eV ، امتصت فوتونا فأصبحت في مستوى الطاقة الأعلى التالي . ما مقدار طاقة الفوتون ؟ وما مقدار تردده ؟
الجواب :

السؤال : ما الطاقات المرتبطة مع مستويات الطاقة لذرة الهيدروجين E2 ، E3 ، E4 ، E5 ، E6 ؟
الجواب :

السؤال : باستخدام القيم المحسوبة في المسألة 51 ، احسب فروق الطاقة بين مستويات الطاقة التالية :
a. E6 - E5
b. E6 - E3
c. E4 - E2
d. E5 - E2
e. E5 - E3
الجواب :

السؤال :استخدم القيم في المسألة 52 لحساب تردد الفوتونات المنبعثة عندما ينجز إلكترون ذرة الهيدروجين تغيرات في مستويات الطاقة المذكورة أعلاه .
الجواب :
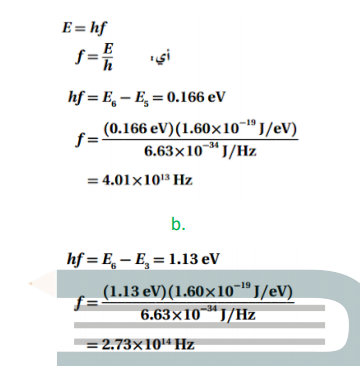

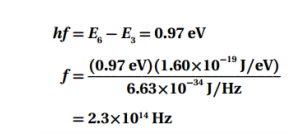
السؤال : احسب الطول الموجي للفوتونات ذات الترددات التي قمت بحسابها في المسألة 53 .
الجواب :

السؤال : تبعث ذرة هيدروجين فوتونا طوله الموجي 94.3 nm عندما تصل إلى حالة الاستقرار . من أي مستوى طاقة انتقال إلكترونها ؟
الجواب :

السؤال : ذرة هيدروجين مثارة إلى n=3 . وفق نموذج بور ، أوجد كلا مما يلي :
a. نصف قطر المستوى
الجواب :
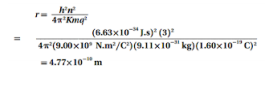
b. القوة الكهربائية بين البروتون والإلكترون .
الجواب :
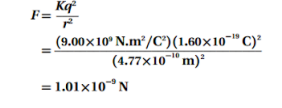
c. التسارع المركزي للإلكترون .
الجواب :
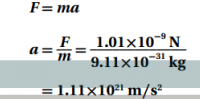
d. السرعة الدورانية للإلكترون ( قارن بين هذه السرعة وسرعة الضوء )
الجواب :

نموذج الذرة الكمي
السؤال : مشغل القرص المدمج CD تستخدم ليزرات زرنيخات الجاليوم كثيرا في مشغلات القرص المدمج . إذا بعث مثل هذا الليزر عند طول موجي 840 nm ، فما مقدار الفرق بوحدة eV بين مستويات الطاقة ؟
الجواب :
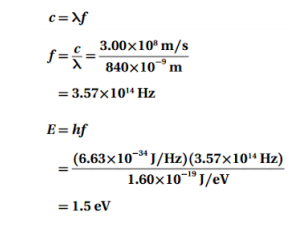
السؤال : أدخل ليزر GaInNi بين مستويات طاقة مفصولة بطاقة مقدارها 2.90 eV .
a. ما الطول الموجي للضوء المنبعث من الليزر ؟
b. في أي جزء من الطيف يقع هذا الضوء ؟
الجواب :

السؤال : يبعث ليزر ثاني أكسيد الكربون بفوتون أشعة تحت حمراء طاقته عالية جدا . ما مقدار فرق الطاقة بوحدة eV بين مستويات الطاقة الليزرية ؟ ارجع إلى الجدول 5-1
الجواب :

السؤال : طاقة حزمة ليزر تساوي حاصل ضرب طاقة كل فوتون منبعث في عدد الفوتونات لكل ثانية .
a. إذا أردت الحصول على ليزر عند طول موجي 840 nm بحيث يكون له القدرة نفسها لليزر طول موجته 427 nm ، فكم مرة يتضاعف عدد الفوتونات في كل ثانية ؟
b. أوجد عدد الفوتونات لكل ثانية في ليزر قدرته 5.0 mW وطوله الموجي 840 nm .
الجواب :
a. بما أن طاقة الفوتون تعطي بالعلاقة E=hf=hc/λ ، فنسبية الطاقة بين الفوتونات في الليزر الثاني إلى الطاقة في الليزر الأول هي 427 / 840 = 0.508 ، لهذا تكون نسبة عدد الفوتونات في الليزر الثاني إلى الأول في كل ثانية 1/0.508 أي 1.97 .
b.

السؤال : ليزرات HeNe يمكن صنع الليزرات HeNe المستخدمة بوصفها مؤشرات يستخدمها المحاضرون ، بحيث تنتج ليزرا عند الاطوال الموجية الثلاثة : 1152.3 nm ، 543.4 nm ، 632.8 nm .
a. أوجد فرق الطاقة بين كل وضعين متضمنين في حزمة كل طول موجي .
b. حدد لون كل طول موجي.
الجواب :
a-

b. أحمر تحت حمراء ، أخضر على الترتيب
مراجعة عامة
السؤال : يدخل فوتون طاقته 14.0 eV ذرة هيدروجين في حالة الاستقرار فيؤينها. ما مقار الطاقة الحركية للإلكترون المتحرر من الذرة ؟
الجواب :

السؤال : احسب نصف قطر المستوى لكل من مستويي الطاقة E5 و E6 لذرة الهيدروجين
الجواب :

السؤال : ذرة هيدروجين في المستوى n=2 :
a. إذا اصطدم فوتون طوله الموجي 332 nm بهذه الذرة فهل تتأين ؟ وضح ذلك .
b. عندما تتأين الذرة ، افترض أن إلكترونا يكتسب الطاقة الزائدة عن التأين ؟ وضح ذلك
الجواب :

السؤال : وجهت حزمة من الإلكترونات إلى عينة من غاز الهيدروجين الذري . ما اقل طاقة للإلكترونات تلزم لينبعث ضوء أحمر ينتج عندما ينتقل إلكترون ذرة الهيدروجين من مستوى الطاقة n= 3 إلى مستوى الطاقة n=2 ؟
الجواب :

السؤال : تستخدم أكثر تجارب المطياف دقة تقنيات ( فةتونين ) ، حيث يوجه فوتونان بأطوال موجية متكافئة على ذرات الهدف من اتجاهين متعاكسين . كل فوتون له نصف الطاقة اللازمة لإثارة الذرات من حالة الاستقرار إلى مستوى الطاقة اللازم . ما طول موجة الليزر الذي يلزم لإنجاز دراسة دقيقة لفرق الطاقة بين n=1 و n=2 في الهيدروجين ؟
الجواب :

التفكير الناقد
السؤال : تطبيق المفاهيم يوضح الشكل 5-23 نتيجة إسقاط طيف مصباح غاز الزئبق ذي الضغط العالي على حائط في غرفة مظلمة . ما فروق الطاقة لكل من الخطوط المرئية الثلاثة ؟

الجواب :

السؤال : تفسير الرسوم التوضيحية بعد انبعاث الفوتونات المرئية التي تم وصفها في المسألة 67 ، تستمر ذرة الزئبق في بعث فوتونات حتى تصل إلى حالة الاستقرار. من خلال اختبار الشكل 5-22 حدد ما إذا كانت هذه الفوتونات مرئية أم لا . فسر ذلك .
الجواب :لا ، الخطوط الطيفية الثلاثة الأعلى طاقة تغادر الذرة في حالات لا تقل طاقتها عن 4.64 eV فوق حالة الاستقرار ، والفوتون بهذه الطاقة يكون طوله الموجي 267 nm ويقع في منطقة الاشعة فوق البنفسجية ، والتغير في الطاقة من المستوى E4 إلى المستوى E2 يتضمن تغيرا في الطاقة مقداره 0.79 eV ، فينتج ضوءا بطول موجي 1570 nm يقع في منطقة الأشعة تحت الحمراء .
السؤال : التحليل والاستنتاج : تتكون ذرة البوزوترونيوم من إلكترون وضديد مادتها النسبي ( بوزترون ) يرتبطان معا . وعلى الرغم من أن فترة الحياة لهذه الذرة صغيرة جدا ( معدل فترة حياتها +1/7 µ s ) فإنه يمكن قياس مستويات طاقتها . يمكن استخدام نموذج بور لحساب الطاقات مع استبدال كتلة الإلكترون بمقدار نصف كتلتها . صف كيف تتأثر أقطار المستويات والطاقة لكل مستوى . كم يكون الطول الموجي عند الانتقال من E2 إلى E1 ؟
الجواب : ستتضاعف أنصاف القطار لأن m تظهر في مقام المعادلة ، في حين الطاقات ستنخفض إلى النصف لأن m تظهر في بسط المعادلة ، أما الأطوال الموجية فستتضاعف لذا فالضوء ينبعث من المستوى E2 إلى المستوى E1 ، أي أن : (2)(121 nm) = 242 nm .
الكتابة في الفيزياء
السؤال : اكتب بحثا عن تاريخ تطور نماذج الذرة . واصفا كل نموذج باختصار ، ومحددا أوجه القوة والضعف فيه .
الجواب : يجب على الطلاب أن يصفوا نموذج ثومبسون " فطيرة البرقوق " والنموذج المداري الكلاسيكي ، ونموذج بور ، والنموذج الكمي ، حيث يفسر النموذج الأول كيف تمتلك الذرات إلكترونات وكتلة ولكن لا يستطيع تفسير كل وجود الإلكترونات وتجارب راذرفورد ، ولكنه نموذج غير مستقر إذ بناءا على هذا النموذج فإن الإلكترونات ستسقط في النواة خلال 1 ns ، أما نموذج بور فسيفسر الأطياف الذرية وينسجم مع نموذج راذرفورد النووي ، ولكنه لم يفسر عدم اليقين ، وكذلك لا يفسر استقرار الذرات عديدة الإلكترونات ، أما النموذج الكمي فيمكن بواسطته تفسير جميع الحقائق المعروفة عن الذرات ، ولكن من الصعب تصوره ، ويتطلب استخدام أجهزة الحاسوب لحل معادلاته .
اقرأ الموضوع التالي النموذج الذري : أقر هنا
السؤال : . بعث مؤشر ليزر أخضر ضوءا طوله الموجي 532 nm . اكتب بحثا في نوع الليزر الذي استخدم في هذا النوع من المؤشرات ، وصف طريقة عمله ، وحدد ما إذا كان الليزر على شكل نبضات أم مستمرا .
الجواب : يستخدم نبضات ليزر Nd عند 164 nm حيث توضح IR داخل بلورة " مضاعف التردد " . وينتج الضوء بنصف ذلك الطول الموجي أو 532 nm .
مراجعة تراكمية
السؤال : فكر في التعديلات التي يحتاج إليها ثومبسون ليجعل أنبوبة يسارع بروتونات بالإضافة إلى الإلكترونات ، ثم أجب عن الأسئلة التالية :
a. لتحديد جسيمات لها السرعة نفسها ، هل ستتغير النسبة E/B ؟ فسر ذلك .
b. للمحافظة على الانحراف نفسه الذي يسببه المجال المغناطيسي ، هل يجب أن يكون المجال المغناطيسي أكبر أم أقل ؟ فسر ذلك .
الجواب :
a. لا ، لأن V=E/B ، نسبة ثابتة لجميع قيم v المعطاة .
b. للكتلة الأكبر ، يجب أن تكون B كبيرة لتبقى r ثابتة .
السؤال : جهد الإيقاف اللازم لاستعادة جميع الإلكترونات المنبعثة للإلكترونات بوحدة الجول ؟
الجواب :
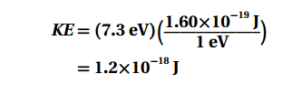
اختبار مقنن
السؤال : أي نماذج الذرة الآتية تعتمد على تجربة صفيحة الذهب الرقيقة لراذرفورد ؟
a. نموذج بور .
b. النموذج النووي .
c. نموذج فطيرة الخوخ .
d. النموذج الكمي الميكانيكي .
الجواب : b. النموذج النووي .
السؤال : تبعث ذرة زئبق ضوءا طول موجته 405 nm . ما مقدار فرق الطاقة بين مستويي الطاقة في هذا الانبعاث ؟
a. 0.22 eV
b. 2.14 eV
c. 3.06 eV
d. 4.05 eV
الجواب : c. 3.06 eV
السؤال : يبين الرسم أدناه مستويات طاقة ذرة الزئبق . ما طول موجة الضوء المنبعث عندما تحدث تحولات في الذرة من مستوى الطاقة E7 إلى المستوى E4 ؟
a. 167 nm
b. 251 nm
c. 500 nm
d. 502 nm
الجواب : d. 502 nm
السؤال : أي الجمل الآتية عن النموذج الكمي للذرة غير صحيحة ؟
a. مستويات الطاقة المسموح بها للذرة مكماة .
b. مواقع الإلكترونات حول النواة معروفة بدقة .
c. تحدد سحابة الإلكترونات المساحة التي يحتمل أن يوجد فيها الإلكترون .
d. ترتبط مستويات الإلكترون المستقرة مع طول موجة دي برولي .
الجواب : b. مواقع الإلكترونات حول النواة معروفة بدقة .
لحل المسألتين 5 و 6 ارجع إلى الرسم التوضيحي الذي يبين سلسلة بالمر لانتقال الإلكترون في ذرة الهيدروجين .
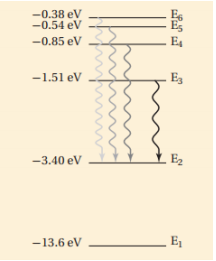
السؤال : أي تحول مسؤول عن انبعاث ضوء بأكبر تردد ؟
a. E2 إلى E5
b. E3 إلى E2
c. E3 إلى E6
d. E6 إلى E2
الجواب : d. E6 إلى E2
السؤال : ما مقدار تردد خط سلسلة بالمر المرتبط بتحول مستوى الطاقة من E4 إلى E2 ؟
(لاحظ أن 1eV = 1.60x10-19 J )
a. 2.55x1014 Hz
b. 4.32x1014 Hz
c. 6.15x1014 Hz
d. 1.08x1015 Hz
الجواب : c. 6.15x1014 Hz
الأسئلة الممتدة
السؤال : حدد الطول الموجي للضوء المنبعث عندما تنجز ذرة الهيدروجين تحولا من مستوى طاقة n=5 إلى مستوى طاقة n=2 ؟
الجواب : 435 nm